题目内容
(18分)(1)1 mol O2与足量氢气反应产生水蒸气放热483.6 kJ,若1 g水蒸气转化成液态水放热2.444 kJ,请写出表示氢气燃烧热的热化学方程式:__________________________________。
(2)由汽油裂解得到乙烯、丙烯是重要的化工原料,请写出下列转化的方程式,并注明反应类型。
丙烯 → 聚丙烯
___________________________________________________
(3)将N2、H2置于容积为2L的密闭容器中,发生反应,反应进行到4S末,测得N2 2mol 、H21.5mol、NH32mol。则用氮气浓度的减少来表示该反应速率为__________ 。
(4)在500ml密闭容器中,将2mol A和1molB混合加热到500℃,达到平衡
2 A(g) +B (g) 3C (g) K =
16求A转化为C的转化率为__________。
3C (g) K =
16求A转化为C的转化率为__________。
(5) 在密闭容器中发生下列反应:aA(g)  cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a
_______ c+d(填“>”、“=”或“<”)。
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a
_______ c+d(填“>”、“=”或“<”)。
(6) 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,反应的化学方程式为______________________________________

H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1

0.125mol/(L.S) 57.1%
< 2N M
M
【解析】(1)燃烧热是指再一定条件下,1mol可燃物完全燃烧,生成稳定的氧化物时所放出的热量,根据题意可知,1mol氢气完全燃烧生成水蒸气时放出的热量是483.6 kJ÷2=241.8 kJ。又因为1 g水蒸气转化成液态水放热2.444 kJ,所以18g水蒸气转化为液态水放出的热量是2.444 kJ×18=44kJ,所以氢气的燃烧热是(241.8+44)kJ/mol,则相应的热化学方程式为H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1。
(2)丙烯中含有碳碳双键,能发生加聚反应,方程式为 。
。
(3)生成氨气是2mol,则消耗氮气是1mol,所以氮气的反应速率是 =0.125mol/(L.S)。
=0.125mol/(L.S)。
(4)
2 A(g) +B (g) 3C (g)
3C (g)
起始浓度(mol/L) 4 2 0
转化浓度(mol/L) 2x x 3x
平衡浓度(mol/L) 4-2x 2-x 3x
所以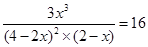
解得x=1.142
因此转化率是1.142÷4×100%=57.1%。
(5)将气体体积压缩到原来的一半的瞬间,A的浓度为原平衡的2倍,但平衡时A的浓度为原平衡的2.1倍,说明增大压强平衡向逆反应方向移动,所以a小于 c+d。
(6)根据图像可知,反应进行到t1时,N减少了2mol,M增加1mol,所以根据变化量之比是相应的化学计量数之比可知,方程式为2N M。
M。


 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。