题目内容
常温下,Ksp(CaSO4)=9´10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是


| A.在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
B.b点将有沉淀生成,平衡后 溶液中c(SO42-)一定等于3´10-3 mol·L—1 溶液中c(SO42-)一定等于3´10-3 mol·L—1 |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
C
略

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
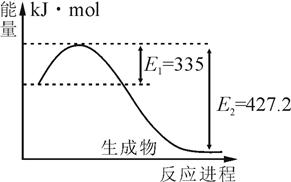
 2NH3(g) △H<0,得到如下数据:
2NH3(g) △H<0,得到如下数据:
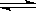 CO(g)+H2(g)
CO(g)+H2(g) 的压强不再发生变化
的压强不再发生变化 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变.变小.变大)。
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变.变小.变大)。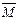 的取值范围是 。
的取值范围是 。 nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是 
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 温度(K)
温度(K) CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。

 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。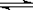 2NH3(g);ΔH =" -92.2" kJ·mol-1。
2NH3(g);ΔH =" -92.2" kJ·mol-1。
 H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol Y(g)+Z(s),
Y(g)+Z(s),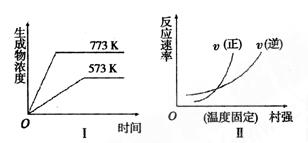
 2NH3(g)ΔH<0
2NH3(g)ΔH<0