题目内容
2.某化合物在核磁共振氢谱中出现6个峰,其结构简式可能是( )| A. |  | B. | 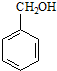 | C. |  | D. | 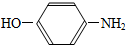 |
分析 化合物的核磁共振氢谱中出现6个峰说明有机物中含有6种类型的氢原子,根据等效氢判断.
分子中等效氢原子一般有如下情况:①分子中同一甲基上连接的氢原子等效,②同一碳原子所连甲基上的氢原子等效,③处于镜面对称位置上的氢原子等效.
解答 解:核磁共振氢谱中出现6个峰说明有机物中含有6种类型的氢原子,则
A.苯环由3种H原子,侧链的甲基上有1种H原子,故分子中有4种H原子,故A错误;
B.苯环由3种H原子,侧链的亚甲基上有1种H原子,羟基上有1种H原子,故分子中有5种H原子,故B错误;
C.苯环由4种H原子,侧链的甲基上有1种H原子,羟基上有1种H原子,故分子中有6种H原子,故C正确;
D.苯环由2种H原子,侧链的氨基上有1种H原子,羟基上有1种H原子,故分子中有4种H原子,故D错误.
故选C.
点评 本题考查对核磁共振氢谱的认识,难度不大,注意分子中等效氢原子的判断.

练习册系列答案
相关题目
12.下列化学反应的离子方程式正确的是( )
| A. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O | |
| B. | 硅酸钠水溶液中通入足量的二氧化碳:SiO32-+CO2+2H2O=H2SiO3(胶体)+CO32- | |
| C. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| D. | 铝片加入烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
13.由M、N两种烃组成的混合物,当混合物质量一定时,无论M、N以何种比例混合,完全燃烧消耗氧气的质量为一恒量.对M、N两种烃的下面几种判断,正确的是( )
| A. | 一定互为同分异构体 | B. | 一定互为同系物 | ||
| C. | 具有相同的最简式 | D. | 烃中碳原子数一定相同 |
10.铍的性质类似于铝,下列有关铍性质和结构的推断正确的是( )
| A. | 铍与铝原子核外具有相同的未成对电子数 | |
| B. | 氢氧化铍能与强酸、强碱溶液反应 | |
| C. | 铍与铝元素具有相同的最高正化合价 | |
| D. | 氧化铍只溶于强酸溶液,不溶于强碱溶液 |
17.下列说法正确的是( )
| A. | 同一周期,从左到右,第一电离能逐渐增大 | |
| B. | 第一电离能越大,金属性越强 | |
| C. | 第三周期,从左到右,主族元素电负性逐渐增大 | |
| D. | 电负性越大,原子半径越大 |
14.某有机物分子式为C2H4O2,且能跟NaOH溶液反应,则下列说法中不正确的是( )
| A. | 该有机物可能是羧酸 | |
| B. | 该有机物可能是酯 | |
| C. | 该有机物可能含有碳碳双键 | |
| D. | 将该有机物和CH4混合,共5mol,完全燃烧,共消耗10mol O2 |
11.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:B、氧,C、钠,D、铝,E、氯;
(2)写出A、B、C形成的化合物M的电子式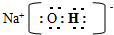 ;
;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(4)E单质与M的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:B、氧,C、钠,D、铝,E、氯;
(2)写出A、B、C形成的化合物M的电子式
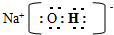 ;
;(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(4)E单质与M的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
12.下列说法正确的是( )
| A. | 按分散剂种类可将分散系分为溶液、胶体和浊液 | |
| B. | 漂白粉、钢、氯水、Fe(OH)3胶体均为混合物 | |
| C. | 过氧化氢与过氧化钠中含有化学键的类型完全相同 | |
| D. | KNO3溶液、铜、熔融的NaCl均能导电,都属于电解质 |
