题目内容
7.(1)铬质极硬,耐腐蚀,能够生成美丽多色的化合物,则铬的价电子排布式为3d54s1.核外电子共有24种运动状态.(2)[Cr(H2O)4C12]Cl•2H2O中Cr的配位数为6;已知CrO5中Cr为+6价,则CrO5中氧元素的化合价有-1和-2,其中σ键和π键个数之比为7:1
(3)Ni(CO)4常温下为无色挥发性液体,Ni(CO)4的晶体类型为分子晶体;写出和CO互为等电子体的分子的结构式为N≡N,阴离子的电子式

(4)乙炔分子中C-H间形成化学键的原子轨道是sp杂化轨道和氢原子的1s轨道.
(5)已知酸性:HNO3>HNO2,请解释原因HNO3中N元素的化合价为+5价,高于HNO2中+3价的N元素,N的化合价越高,它的正电性越高,N-O-H中的电子向N越易偏移,O-H共价键越易断裂,越易电离出H+,酸性越强.
分析 (1)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1;
(2)根据配合物组成判断配位数,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,根据结构式判断;
(3)分子晶体的熔沸点较低,价电子数相等、原子个数相等的微粒为等电子体;
(4)根据碳原子含有的σ键和孤电子对个数确定杂化类型,碳原子的杂化轨道和氢原子的1s轨道形成化学键;
(5)根据N元素化合价越高,它的正电性越高,N-O-H中的电子向N越易偏移,O-H共价键越易断裂,越易电离出H+,酸性越强;
解答 解:(1)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,所以价电子排布式为3d54s1,每个电子的运动状态都不同,则有24种不同的电子,故答案为:3d54s1;24;
(2)[Cr(H2O)4Cl2]Cl•2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6,CrO5中Cr为+6价,根据化合价代数和为0,所以CrO5中氧元素的化合价有-1和-2价;
则CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,结构为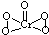 ,所以σ键和π键个数之比为7:1;故答案为:6;-1和-2;7:1;
,所以σ键和π键个数之比为7:1;故答案为:6;-1和-2;7:1;
(3)分子晶体的熔沸点较低,所以该物质为分子晶体,和CO互为等电子体的分子氮气的结构式为N≡N,由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式为 ,
,
故答案为:分子晶体;N≡N; .
.
(4)乙炔分子中的C以碳碳三键采用sp杂化,所以乙炔分子中C-H间碳原子的sp杂化轨道和氢原子的1s轨道形成化学键,
故答案为:sp杂化轨道和氢原子的1s轨道;
(5)因为N元素化合价越高,它的正电性越高,N-O-H中的电子向N越易偏移,O-H共价键越易断裂,越易电离出H+,酸性越强,所以酸性HNO3>HNO2的原因为HNO3中N元素的化合价为+5价,高于HNO2中+3价的N元素,N的化合价越高,它的正电性越高,N-O-H中的电子向N越易偏移,O-H共价键越易断裂,越易电离出H+,酸性越强,故答案为:HNO3中N元素的化合价为+5价,高于HNO2中+3价的N元素,N的化合价越高,它的正电性越高,N-O-H中的电子向N越易偏移,O-H共价键越易断裂,越易电离出H+,酸性越强.
点评 本题考查了物质结构和性质,涉及等电子体、原子的杂化方式、核外电子排布式的书写等知识点,这些知识点都是高考热点,根据价层电子对互斥理论确定原子杂化方式等,难度中等.

| A. | C4H6、C3H8 | B. | C2H2、C6H6 | C. | C2H6O、C2H4 | D. | C3H6、C3H8 |
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 离子晶体中可能含有共价键 | |
| C. | 原子晶体中的相邻原子间只存在非极性共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |
| A. |  | B. | 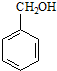 | C. |  | D. | 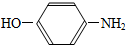 |
| A. | 新制Cu(OH)2悬浊液 | B. | KMnO4溶液 | C. | 溴水 | D. | FeCl3溶液 |

| A. | 该有机物难溶于水 | |
| B. | 该物质能与溴水反应,生成难溶于水的沉淀 | |
| C. | 该分子中至少有12个原子共平面 | |
| D. | 1 mol该物质与足量的金属钠反应,放出3mol H2 |
| A. | 某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中可能有SO42- | |
| B. | 某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中可能有Cl- | |
| C. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中可能有CO32- | |
| D. | 某溶液中滴入氢氧化钠溶液,生成白色沉淀,说明原溶液中可能有Fe3+ |
| A. | Cl-→Cl2 | B. | Fe3+→Fe2+ | C. | O2→O3 | D. | CuO→Cu |
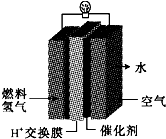 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,