题目内容
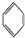
12.下列各项不属于官能团的是( )| A. | NO3- | B. | -NO2 | C. | -OH | D. | 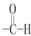 |
分析 决定有机物性质的原子或原子团为官能团,常见官能团有碳碳双键、羟基、醛基、羧基以及酯基、肽键等,以此解答该题.
解答 解:能决定化合物特殊性质的原子或原子团才是官能团,且官能团为电中性,-NO2、-OH、-CHO为官能团,而NO3-为酸根离子,不是官能团,
故选:A.
点评 本题考查常见有机物的官能团的识别,难度不大,注意把握官能团的结构简式以及性质,学习中注意相关基础知识的积累.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
2.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊.再升高至65℃以上,溶液变澄清. | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. | Na2AlO2溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去. | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
20.下列原子的价电子构型中,第一电离能最小的是( )
| A. | 2s22p4 | B. | 3s23p4 | C. | 4s24p4 | D. | 5s25p4 |
7.下列有关元素周期表的说法中正确的是( )
| A. | 元素周期表有18个族 | |
| B. | 第IA族元素称为碱金属元素 | |
| C. | 原子最外层电子数相同的元素,一定属于同一族 | |
| D. | 第3列至第12列的元素全为金属元素 |
1.在常温常压下,取下列等质量4种气态烃,分别在足量的氧气中燃烧,其中消耗氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |

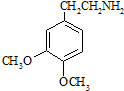 .
.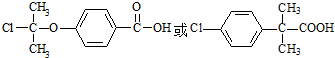 .
. (R、R′为烃基).根据已有知识并结合相关信息,写出以乙醇为原料制备
(R、R′为烃基).根据已有知识并结合相关信息,写出以乙醇为原料制备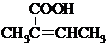 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: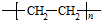
 、④HCHO,其中碳原子采取sp2杂化的分子有①③④
、④HCHO,其中碳原子采取sp2杂化的分子有①③④