题目内容
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1L1mol/L FeCl3溶液中所含Fe3+的数目为NA | |
| B. | 1mol NaHSO4晶体中所含离子的数目为2NA | |
| C. | 1mol NO2溶于足量水中,转移电子的数目为NA | |
| D. | 常温常压下,22.4L HCHO中所含σ键的数目为3NA |
分析 A、Fe3+是弱碱阳离子,在溶液中会水解;
B、NaHSO4晶体中含1个钠离子和1个HSO4-离子;
C、NO2与水的反应是歧化反应;
D、常温常下下,甲醛为液体.
解答 解:A、Fe3+是弱碱阳离子,在溶液中会水解,故溶液中Fe3+的个数小于NA个,故A错误;
B、NaHSO4晶体中含1个钠离子和1个HSO4-离子,故1mol的NaHSO4晶体中含1mol钠离子和1molHSO4-离子,即含2mol离子,故B正确;
C、NO2与水的反应是歧化反应,3molNO2转移2mol电子,故1molNO2转移$\frac{2}{3}$mol电子,故C错误;
D、常温常下下,甲醛为液体,故22.4L甲醛的物质的量不是1mol,故D错误.
故选B.
点评 本题考查了物质的量的有关计算,掌握公式的运用和物质的状态是解题关键,难度不大.

练习册系列答案
相关题目
18.W、X、Y、Z四种元素是原子序数依次增大的短周期主族元素,已知:①四种元素的电子层数之和等于10,且它们是连续的四种主族元素;②四种元素的原子,其半径最大的是X原子.下列说法正确的是( )
| A. | W和X均位于第二周期 | B. | Y和Z分别是Al和Si | ||
| C. | W和X分别是O和F | D. | Z的金属性可能比X强 |
16.已知XO32-有42个电子,有关X原子的描述正确的是( )
| A. | X原子核外有16个电子 | |
| B. | XO32-有42个质子 | |
| C. | X的氧化物对应的水化物是一种强酸 | |
| D. | X为金属元素 |
13.某化合物6.2g在O2中完全燃烧,只生成8.8g CO2和5.4g H2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:2 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
20.下列芳香烃的一氯代物的同分异构体数目最多的是( )
| A. | 连二苯 | B. | 连三苯  | C. | 菲 | D. | 蒽  |
17.铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电过程中,负极附近溶液的pH降低 | |
| C. | 电池放电时,若外电路中有2mol电子转移,则内电路中有2molOH-移向正极 | |
| D. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 |
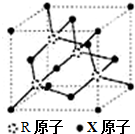 X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等.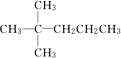 ,并对其命名2,2-二甲基戊烷.其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.
,并对其命名2,2-二甲基戊烷.其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯. 可以被KMnO4的酸性溶液氧化生成
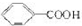
可以被KMnO4的酸性溶液氧化生成  ,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到  .
. 的异构体共有7种,其中的3种是
的异构体共有7种,其中的3种是 CH2CH2CH2CH2,
CH2CH2CH2CH2,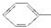 CH(CH2)CH2CH2CH2,
CH(CH2)CH2CH2CH2, CH2CH(CH2)CH2CH2
CH2CH(CH2)CH2CH2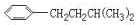 、
、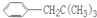 、
、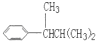 、
、 .
.