题目内容
【题目】(1)对于下列反应:2SO2(g) + O2(g)![]() 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
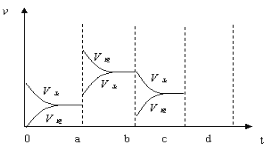
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________; 若增大压强时,反应速度变化情况画在c~d处。
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________; 若增大压强时,反应速度变化情况画在c~d处。
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将___________(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时____________(填“增大”、“减小”或“相等”)。
【答案】(1)2mol/(L·min) 2mol/L (2)升温 减小 SO3 浓度 (3)降低 减小
【解析】
试题分析:(1)根据v=△c/△t计算用SO2浓度变化来表示的化学反应速率为(6mol/L-2mol/L)/2min=2mol/(L·min);根据反应方程式的化学计量数关系可知v(SO2)=2v(O2)=2×0.5mol/(L·min)=1 mol/(L·min),2min后反应达平衡后SO2的浓度变化为2mol/L,那么2min时SO2的浓度为2mol/L。
(2)根据图像知a时刻,改变条件逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果;b时刻正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物SO3的浓度;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为
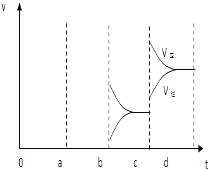 。
。
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍相当于减小压强,平衡向气体物质的量增大的逆向移动,由(2)分析知该反应正向为放热反应,达新平衡时,容器内温度将降低;达新平衡时,容器内气体的质量不变,气体的物质的量增大,容器内混合气体的平均相对分子质量比原平衡时减小。