题目内容
【题目】工业生产的纯碱中常含有少量的NaCl杂质,某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数。
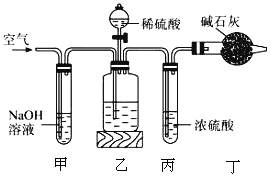
(1)甲装置反应的离子方程式是________________________。
(2)乙装置反应完成后,再通数分钟空气的作用是______________。
(3)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为wg,则Na2CO3质量分数的计算式为______________。
(4)若去掉丙装置,测得的CO2质量会______________(填“偏大”“偏小”或“无影响”)。
(5)有同学认为在丁后面还要再连一个跟丁一样的装置,目的是__________________。
【答案】
(1)CO2+2OH-=CO32-+H2O;
(2)将生成的CO2完全排出到丁中;
(3)![]() ×100%;(4)偏大;
×100%;(4)偏大;
(5)防止空气中的H2O和CO2进入装置丁
【解析】
试题分析:(1)装置甲中二氧化碳与氢氧化钠反应生成碳酸钠与水,反应的离子方程式为CO2+2OH-=CO32-+H2O,故答案为:CO2+2OH-=CO32-+H2O;
(2)乙装置反应结束后,装置中含有二氧化碳,不将二氧化碳排尽,会使测定的二氧化碳的质量偏小,故反应后再通空气,排尽装置内的二氧化碳,使之全部被丁装置吸收,故答案为:将生成的CO2完全排出到丁中;
(3)由题意可知,反应生成的二氧化碳的质量为(w-m)g,二氧化碳的物质的量为![]() =
=![]() mol,根据碳元素守恒可知样品中碳酸钠的物质的量为
mol,根据碳元素守恒可知样品中碳酸钠的物质的量为![]() mol,样品中碳酸钠的质量为
mol,样品中碳酸钠的质量为![]() mol×106g/mo=
mol×106g/mo=![]() g,样品中碳酸钠质量分数为
g,样品中碳酸钠质量分数为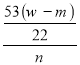 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%;
×100%;
(4)从装置乙中产生导出的气体中含有水,如果不除去气体中的水,会使丁中测定的二氧化碳的质量增大,导致测定的样品中碳酸钠的质量增大,测定的碳酸钠质量分数偏大,故答案为:偏大;
(5)空气中二氧化碳、水蒸气进入丁中影响二氧化碳的质量测定,导致测定二氧化碳的质量增大,在丁后面还要再连一个跟丁一样的装置戊装置的作用是吸收二氧化碳中的水蒸气,防止进入装置丁中,故答案为:防止空气中的H2O和CO2进入装置丁。

 阅读快车系列答案
阅读快车系列答案