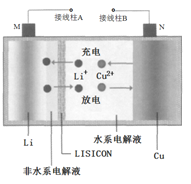
题目内容
【题目】工业上制硫酸的主要反应之一为2SO2(g)+O2(g)![]() 2SO2(g),反应过程中能量的变化如图所示。
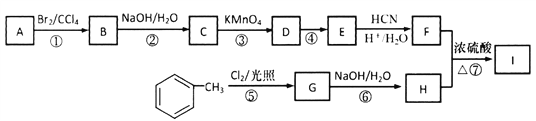
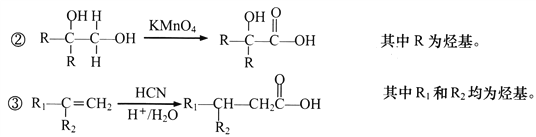
2SO2(g),反应过程中能量的变化如图所示。
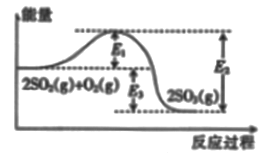
(1)由图可知该反应的正反应为_________ (填“吸热”或“放热”) 反应。
(2)向反应体系中加入催化剂后,图中E1_______(填“增大”“或“减小”或“不变”,下同),E3______。
(3)已知:2H2S(g)+O2(g)==2S(s)+2H2O(g) ΔH=-442.4kJ/mol
S(s)+O2(g)==SO2(g) ΔH=-297.0 kJ/mol 。
若H2S(g)与O2(g)反应产生SO2(g)和H2O(g),则消耗0.5mol H2S时,反应中转移的电子总数为_______(用NA 表示阿伏加德罗常数的数值),放出的热量为_______kJ。
【答案】 放热 减小 不变 3NA 259.1
【解析】(1)由图像可知反应物总能量大于生成物总能量,则该反应的正反应为放热反应,故答案为:放热;
(2)E1为活化能,E3为反应热,加入催化剂,可降低反应的活化能,但反应热不变,因此E1减小,E3不变,故答案为:减小;不变;
(3)已知:①2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=-442.4kJmol-1;②S(s)+O2 (g)═SO2 (g)△H=-297.0kJmol-1,利用盖斯定律,将①+②×2可得2H2S(g)+3O2(g)═2SO2(g)+2H2O(g) △H=-1036.4kJmol-1。则消耗0.5molH2S时,反应中转移的电子为3mol,数目为3NA,放出的热量为1036.4kJ ×![]() =259.1kJ,故答案为:3NA;259.1。
=259.1kJ,故答案为:3NA;259.1。

【题目】下列实验操作规范且能达到实验目的的是
操作 | 目的 | |
A | 称取5.0gCuSO4·5H2O加入27.0g水中,搅拌溶解 | 配制10%CuSO4溶液 |
B | 先用稀盐酸洗涤,再用水清洗 | 洗涤分解KMnO4制O2的试管 |
C | 用玻璃棒蘸取溶液,点在干燥的pH试纸上,片刻后与标准比色卡比较并读数 | 测定0.05mol.L-1NaClO溶液的pH |
D | 将粗碘放入烧杯中,烧杯口放一盛满冷水的烧瓶,隔石棉网对烧杯加热,然后收集烧瓶外壁的固体 | 提纯混有NH4Cl的粗碘 |
A. A B. B C. C D. D