题目内容
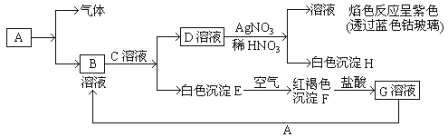
【题目】(题文)(2018·山东省青岛市5月第二次模拟检测)有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:
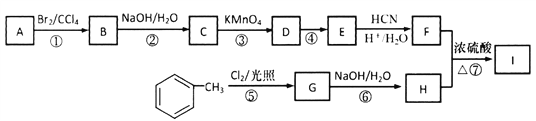
已知:①A属于脂肪烃,核磁共振氢谱显示有2组峰,面积比为3:1,其蒸汽在标准状况下密度为2.5g·L-1;D分子式为C4H8O3;E分子式为C4H6O2,能使溴水褪色。
回答下列问题:
(1)A的结构简式为___________________;分子中共面的原子至少有__________个。
(2)D中官能团的名称是______________________。
(3)反应④的化学方程式为____________________________________。
(4)E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有____________种。
(5)反应①~⑦属于取代反应的是__________________________________(填序号)。
(6)反应⑦的化学方程式为_______________________________________。
(7)参照上述合成路线,以 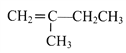 为原料(无机试剂任选),经4步反应制备可降解塑料
为原料(无机试剂任选),经4步反应制备可降解塑料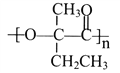 _____________________。
_____________________。
【答案】 ![]() 6 羟基、羧基
6 羟基、羧基 
![]()
![]() +H2O 8 ②⑤⑥⑦ 2
+H2O 8 ②⑤⑥⑦ 2![]() +
+![]()
![]()
![]() +2H2O
+2H2O ![]()
![]()
![]()

![]()
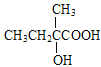
![]()
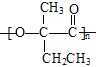
【解析】试题分析:本题考查有机推断和有机合成,考查有机物分子式和结构简式的确定、官能团的识别、有机物结构简式和有机方程式的书写、共面原子个数的确定、限定条件同分异构体数目的确定和有机合成路线的设计。根据已知①,M(A)=2.5g/L![]() 22.4L/mol=56g/mol,A属于脂肪烃,用“商余法”,56
22.4L/mol=56g/mol,A属于脂肪烃,用“商余法”,56![]() 14=4,A的分子式为C4H8,A的核磁共振氢谱显示有2组峰且面积比为3:1,A的结构简式为
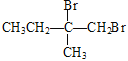
14=4,A的分子式为C4H8,A的核磁共振氢谱显示有2组峰且面积比为3:1,A的结构简式为![]() ;A与Br2/CCl4发生加成反应生成B,B的结构简式为
;A与Br2/CCl4发生加成反应生成B,B的结构简式为 ;B与NaOH/H2O发生取代反应生成C,C的结构简式为
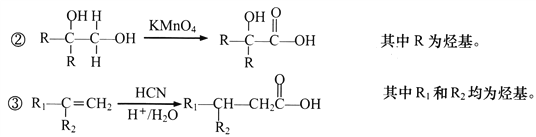
;B与NaOH/H2O发生取代反应生成C,C的结构简式为 ;D的分子式为C4H8O3,根据已知②,由C与KMnO4发生氧化反应生成的D的结构简式为
;D的分子式为C4H8O3,根据已知②,由C与KMnO4发生氧化反应生成的D的结构简式为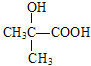 ;E的分子式为C4H6O2,E能使溴水褪色,D→E为消去反应,E的结构简式为
;E的分子式为C4H6O2,E能使溴水褪色,D→E为消去反应,E的结构简式为![]() ;根据E→F的反应条件,结合已知③,F的结构简式为
;根据E→F的反应条件,结合已知③,F的结构简式为![]() ;
;![]() 与Cl2光照下发生-CH3上的取代反应生成G,G→H为氯代烃的取代反应,I属于芳香酯类物质,F+H→I为酯化反应,I的分子式为C19H20O4,则G的结构简式为
与Cl2光照下发生-CH3上的取代反应生成G,G→H为氯代烃的取代反应,I属于芳香酯类物质,F+H→I为酯化反应,I的分子式为C19H20O4,则G的结构简式为![]() ,H的结构简式为
,H的结构简式为![]() ,I的结构简式为
,I的结构简式为![]() 。
。
(1)A的结构简式为![]() 。与碳碳双键直接相连的2个H原子和2个碳原子、以及2个双键碳原子一定共平面,分子中共面的原子至少有6个。
。与碳碳双键直接相连的2个H原子和2个碳原子、以及2个双键碳原子一定共平面,分子中共面的原子至少有6个。
(2)D的结构简式为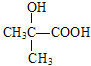 ,D中官能团的名称是羟基、羧基。
,D中官能团的名称是羟基、羧基。
(3)反应④是醇的消去反应,反应的化学方程式为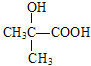
![]()
![]() +H2O。
+H2O。
(4)E的分子式为C4H6O2,E的同系物K比E多一个碳原子,K的分子式为C5H8O2;K的不饱和度为2,K的同分异构体能发生银镜反应且能水解,结合所含O原子个数,K的同分异构体为甲酸某酯;符合条件的链状同分异构体有:HCOOCH=CHCH2CH3、HCOOCH2CH=CHCH3、HCOOCH2CH2CH=CH2、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,共8种。
,共8种。
(5)反应①~⑦的反应类型依次为:加成反应、取代反应(或水解反应)、氧化反应、消去反应、取代反应、取代反应(或水解反应)、取代反应(或酯化反应),属于取代反应的是②⑤⑥⑦。
(6)反应⑦为F与H的酯化反应,反应的化学方程式为:2![]() +
+![]()
![]()
![]() +2H2O。
+2H2O。
(7)用切割法,高分子化合物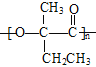 的单体是
的单体是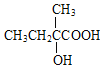 ;对比
;对比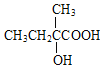 和原料
和原料![]() 的结构简式,碳干骨架不变,官能团发生变化;
的结构简式,碳干骨架不变,官能团发生变化;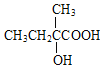 含羟基和羧基,
含羟基和羧基,![]() 含碳碳双键,模仿流程中A→B→C→D,即由
含碳碳双键,模仿流程中A→B→C→D,即由![]() 与Br2/CCl4发生加成反应生成
与Br2/CCl4发生加成反应生成 ,
, 发生水解反应生成
发生水解反应生成 ,
, 与KMnO4发生氧化反应生成
与KMnO4发生氧化反应生成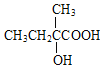 ,
,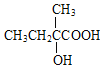 发生缩聚反应生成
发生缩聚反应生成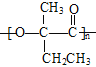 ,合成路线流程图为:
,合成路线流程图为:![]()
![]()

![]()

![]()
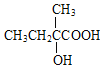
![]()
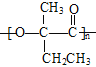 。
。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案