题目内容
【题目】某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.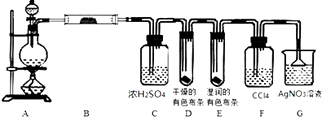
(1)用MnO2和浓盐酸混合共热制得氯气的化学方程式是;
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2 , 制得的Cl2体积在标准状况下总是小于1.12L的原因是;
(3)①装置B的作用是;②装置D和E出现的不同现象说明的问题是;
③装置F的作用是;
④装置G中发生反应的化学方程式为 .
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应
(3)检验制备的氯气中水蒸气;氯气没有漂白性,氯水有漂白性;除去氯气,防止对HCl气体检验的干扰;HCl+AgNO3═AgCl↓+HNO3
【解析】解:(1)实验室利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,所以答案是:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应,有0.2mol HCl的浓盐酸与足量的MnO2反应制得的Cl2体积在标准状况下总是小于1.12L,所以答案是:加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应;(3)①装置B中盛放无水硫酸铜,白色固体变为蓝色,说明制备氯气中含有水蒸气,所以答案是:检验制备的氯气中水蒸气;②干燥的氯气没有漂白性,D中有色布条不褪色,氯气与水反应生成的HClO具有漂白性,E中湿润的有色布条褪色,说明氯气没有漂白性,氯水有漂白性所以答案是:氯气没有漂白性,氯水有漂白性;③氯气通入硝酸银溶液也会生成AgCl沉淀,装置F的作用:除去氯气,防止对HCl气体检验的干扰,所以答案是:除去氯气,防止对HCl气体检验的干扰;④G中HCl与硝酸银溶液反应生成AgCl沉淀,反应离子方程式为:HCl+AgNO3═AgCl↓+HNO3 , 所以答案是:HCl+AgNO3═AgCl↓+HNO3 .
MnCl2+Cl2↑+2H2O;(2)加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应,有0.2mol HCl的浓盐酸与足量的MnO2反应制得的Cl2体积在标准状况下总是小于1.12L,所以答案是:加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应;(3)①装置B中盛放无水硫酸铜,白色固体变为蓝色,说明制备氯气中含有水蒸气,所以答案是:检验制备的氯气中水蒸气;②干燥的氯气没有漂白性,D中有色布条不褪色,氯气与水反应生成的HClO具有漂白性,E中湿润的有色布条褪色,说明氯气没有漂白性,氯水有漂白性所以答案是:氯气没有漂白性,氯水有漂白性;③氯气通入硝酸银溶液也会生成AgCl沉淀,装置F的作用:除去氯气,防止对HCl气体检验的干扰,所以答案是:除去氯气,防止对HCl气体检验的干扰;④G中HCl与硝酸银溶液反应生成AgCl沉淀,反应离子方程式为:HCl+AgNO3═AgCl↓+HNO3 , 所以答案是:HCl+AgNO3═AgCl↓+HNO3 .
【考点精析】掌握氯气的实验室制法是解答本题的根本,需要知道实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案