��Ŀ����
����Ŀ��1905��¹���ѧ�ҹ��������˺ϳɰ��ķ���������˻����1918���ŵ������ѧ�������ĺϳɲ�������˵���������ʳ��������µļ������������⣬�ڹ�������Դ���Ṥҵ����Ҳ�й㷺��;��
����Ϊԭ�ϣ��ϳ����صķ�Ӧԭ��Ϊ��
2NH3��g��+CO2��g���TCO��NH2��2��l��+H2O��g����H=a kJ/mol��
Ϊ�о�ƽ��ʱCO2��ת�����뷴Ӧ��Ͷ�ϱȣ� ![]() �����¶ȵĹ�ϵ���о�С����10L�����ܱ������н���ģ�ⷴӦ���������ͼ�������߷ֱ��ʾ�ڲ�ͬͶ�ϱ�ʱ��CO2��ת�������¶�֮��Ĺ�ϵ����
�����¶ȵĹ�ϵ���о�С����10L�����ܱ������н���ģ�ⷴӦ���������ͼ�������߷ֱ��ʾ�ڲ�ͬͶ�ϱ�ʱ��CO2��ת�������¶�֮��Ĺ�ϵ����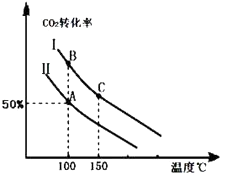
��1��a0 ���������������������� ��
��2����Ͷ�ϱȣ����������������
����n��CO2����ʼ=10mol�����ߢ��Ͷ�ϱ�Ϊ0.4����100�������·�����Ӧ����ƽ����A�㣬��A������ʼѹǿ��Ϊ ��
��A��ƽ�ⳣ����B��ƽ�ⳣ����Ĺ�ϵ��KAKB�������������=������B������Ӧ������C������Ӧ���ʼ�Ĺ�ϵΪ��v��B��v��C���������������=������
��3���������ߢ��Ͷ�ϱ�Ͷ�ϣ�������ʵ����ѹ�����������5L����ͼ�л�����Ӧ��ƽ��ʱ�Ķ�����̼��ת�������¶�֮��Ĺ�ϵ���ߣ�
��4��Ϊ���CO2ת���ʿ��Բ�ȡ�Ĵ�ʩ�� ��
a��ʹ�ô��� b����ʱ����ϵ�з��������CO��NH2��2c������ϵ�е�ˮ����Һ������
���������ڹ�ҵ���������ᣬ��β���е�NO2���ð�ˮ������������泥�25��ʱ����10molNH4NO3����ˮ����Һ�����ԣ������Һ�еμ�1LijŨ�ȵİ�ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫����������������� �ƶ�����������Һ��NH3H2O�����ʵ���Ϊmol����25��ʱ��NH3H2O�ĵ���ƽ�ⳣ��Kb=2��10��5��
���𰸡�
��1������Ͷ�ϱ���ͬʱ���¶�Խ�ߣ�������̼��ת����Խ�ͣ�˵��ƽ�����淽���ƶ���������Ϊ���ȷ�Ӧ
��2������5��7��=����
��3��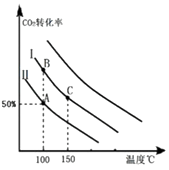
��4��c������0.05
���������⣺��1����ͼ��֪��Ͷ�ϱ���ͬʱ���¶�Խ�ߣ�������̼��ת����Խ�ͣ�˵��ƽ�����淽���ƶ����淽��Ϊ���ȷ�Ӧ��������Ϊ���ȷ�Ӧ����H��0����a��0��
���Դ��ǣ�����Ͷ�ϱ���ͬʱ���¶�Խ�ߣ�������̼��ת����Խ�ͣ�˵��ƽ�����淽���ƶ���������Ϊ���ȷ�Ӧ����2������ͬ�¶��£�Ͷ�Ϣ�ʱCO2��ת���ʸߣ�Ͷ�Ϣ��ת���ʵͣ��ڹ̶�����������������������߶�����̼��ת���ʣ�˵����Ӧ��Ͷ�ϱ� ![]() �Ǣ��е�С��
�Ǣ��е�С��
���Դ��ǣ���������n��CO2����ʼ=10mol�����ߢ��Ͷ�ϱ�Ϊ0.4����n��NH3��= ![]() =25mol���ﵽƽ��A��ʱ��������̼��ת����Ϊ50%����������ʽ��
=25mol���ﵽƽ��A��ʱ��������̼��ת����Ϊ50%����������ʽ��
2NH3��g�� | + | CO2��g�� | �T | CO��NH2��2��l�� | + | H2O��g�� | |
��ʼ���� | 25mol | 10mol | 0mol | 0mol | |||
�ı����� | 10mol | 5mol | 5mol | 5mol | |||
ƽ������ | 15mol | 5mol | 5mol | 5mol |
��ƽ��ʱ���������ʵ���Ϊ25mol����ʼ���������ʵ���Ϊ35mol����A������ʼѹǿ��=���ʵ���֮�ȣ��� ![]() =
= ![]() ��
��
���Դ��ǣ�5��7����A���B����¶���ͬ������ƽ�ⳣ����ͬ��C����¶ȸ��ߣ�����C������Ӧ���ʱ�B�������Ӧ���ʸߣ�
���Դ��ǣ�=��������3�������ߢ��Ͷ�ϱ�Ͷ�ϣ�ѹ�����������ƽ�������������С�ķ����ƶ������������ƶ���������̼��ת��������������ͬ�¶��£�������̼��ת����ͬ�ȳ̶ȸ���Ͷ�Ϣ��ɴ�ƽ���Ļ������ߣ� 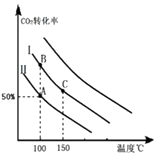 ��
��
���Դ��ǣ�  ����4��a��ʹ�ô�����ƽ�ⲻ�ƶ���������߶�����̼��ת���ʣ���a����
����4��a��ʹ�ô�����ƽ�ⲻ�ƶ���������߶�����̼��ת���ʣ���a����
b����ʱ����ϵ�з��������CO��NH2��2 �� ���ص�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���������߶�����̼��ת���ʣ���b����
c������ϵ�е�ˮ����Һ�����룬��С������Ũ�ȣ�ƽ�������ƶ�������˶�����̼��ת���ʣ���c��ȷ��
���Դ��ǣ�c��
��NH4NO3����ˮ����Һ�����ԣ���笠���ˮ������NH4++H2ONH3H2O+H+ �� ˮ��ٽ�ˮ�ĵ��룬�����Һ�еμ�1LijŨ�ȵİ�ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫�ܵ����ƣ��������ƶ��������Һ�еμ�1Lϡ��ˮ����Һ�����Կ�֪��c��OH����=10��7mol/L��
��ƽ��ʱNH3H2O�����ʵ���Ϊx����Һ�����Ϊ1L��
��
NH3H2O | NH4+ | + | OH�� | ||
ƽ��ʱ��Ũ�ȣ�mol/L ���� | x | 10 | 10��7 |
�ɵ���ƽ�ⳣ����֪�� ![]() =2��10��5 �� x=0.05��
=2��10��5 �� x=0.05��
���Դ��ǣ�����0.05��
�����㾫����������Ҫ�����˻�ѧƽ��״̬���ʼ����������������ˮ��Һ�еĵ���ƽ������֪ʶ�㣬��Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ��������ȷ�����⣮

 �ŵ������ϵ�д�
�ŵ������ϵ�д�����Ŀ������ʧȥ��ǩ��CaCl2��AgNO3��HCl����Na2CO3��ƿ��Һ��Ϊ��ȷ��������Һ�ijɷ֣������DZ��ΪA��B��C��D����л�ѧʵ�飮ʵ���¼���£�
ʵ��˳�� | ʵ������ | ʵ������ |
�� | A+B | ���������� |
�� | B+D | ����ɫ��ζ����ų� |
�� | C+B | �а�ɫ�������� |
�� | A+D | �а�ɫ�������� |
��������ʵ��������и�С�⣺
��1��A��B��C��D��ƿ��Һ�ֱ��ǣ��û�ѧʽ��ʾ�������ʣ�ABCD
��2��д��B��D��Ӧ�����ӷ���ʽд��B��C��Ӧ�����ӷ���ʽ ��
����Ŀ�����ݱ�����Ϣ�жϣ�����ѡ����ȷ���ǣ� ��
��� | ��Ӧ�� | ���� |
�� | KMnO4��H2O2��H2SO4 | K2SO4��MnSO4�� |
�� | C12��FeBr2 | FeC13��FeBr3 |
�� | MnO | Cl2��Mn2+�� |
A.�ڢ��鷴Ӧ���������ΪH2O
B.�ڢ��鷴Ӧ��Cl2��FeBr2�����ʵ���֮��С�ڻ����1��2
C.�ڢ��鷴Ӧ������1mol Cl2 �� ת�Ƶ���5mol
D.��������ǿ����˳��ΪMnO ![]() ��Cl2��Fe3+��Br2
��Cl2��Fe3+��Br2