题目内容
【题目】(1)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s)+CO2(g) H1
1/4CaS(s)+CO2(g) H1
②CaSO4(s)+CO(g) ![]() CaO(s)+CO2(g) +SO2(g) H2
CaO(s)+CO2(g) +SO2(g) H2
③CO(g) ![]() 1/2C(s)+1/2CO2(g) H3
1/2C(s)+1/2CO2(g) H3
则反应2CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的H=
CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的H=
(用H1、H2和H3表示)
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
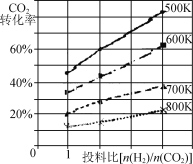
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH____(填“>”“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将 (填“增大”“减小”或“不变”)。
③二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为 。
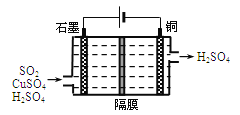
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2nCu+(n+1)O2+(2-2n) H2O=2nCuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的总的离子方程式: 。
【答案】(1)4H1+ H2+2H3 (2)① [c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2)] ②<;不变
③CH3OCH3-12e-+3H2O===2CO2↑+12H+ (3)①减少酸雨的发生
②SO2+2H2O+Cu2+![]() 4H++SO42—+Cu
4H++SO42—+Cu
【解析】
试题分析:(1)由盖斯定律,反应①+反应②+反应③得反应2CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g),所以H=4H1+ H2+2H3 ;(2)①该反应平衡常数表达式为K=[c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2)] ;②由图像可知,投料比一定时,温度越高,CO2的转化率越低,是放热反应,ΔH <0;化学平衡常只与温度有关,与投料比无关,若温度不变,则K不变;③甲醚发生氧化反应作负极,在酸性条件下,负极反应为:CH3OCH3-12e-+3H2O===2CO2↑+12H+ ;(3)①从环境保护的角度看,催化脱硫的意义为减少酸雨的发生;②根据装置图可知SO2被氧化,Cu2+被还原反应的总离子方程式为SO2+2H2O+Cu2+
CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g),所以H=4H1+ H2+2H3 ;(2)①该反应平衡常数表达式为K=[c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2)] ;②由图像可知,投料比一定时,温度越高,CO2的转化率越低,是放热反应,ΔH <0;化学平衡常只与温度有关,与投料比无关,若温度不变,则K不变;③甲醚发生氧化反应作负极,在酸性条件下,负极反应为:CH3OCH3-12e-+3H2O===2CO2↑+12H+ ;(3)①从环境保护的角度看,催化脱硫的意义为减少酸雨的发生;②根据装置图可知SO2被氧化,Cu2+被还原反应的总离子方程式为SO2+2H2O+Cu2+![]() 4H++SO42—+Cu 。
4H++SO42—+Cu 。

【题目】苯胺为无色液体,还原性强,易被氧化;有碱性,与酸反应生成盐。常用硝基苯与H2制备:![]() 。
。
其部分装置及有关数据如下: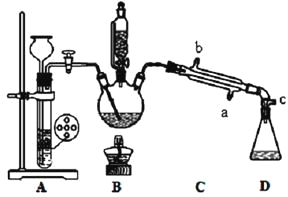
沸点/℃ | 密度g/mL | 溶解性 | |
硝基苯 | 210.9 | 1.20 | 不溶于水,易溶于乙醇、乙醚 |
苯胺 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚 |
乙醚 | 34.6 | 0.71 | 不溶于水,易溶于硝基苯、苯胺 |
实验步骤:
①检查装置的气密性,连接好C处冷凝装置的冷水。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压分液漏斗,换上温度计。
③打开装置A、B间活塞,通入H2一段时间。
④点燃B处的酒精灯,加热,使温度维持在140℃进行反应。
⑤反应结束后,关闭装置A、B间活塞,加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
回答下列问题:
(1)步骤⑥中温度计水银球的位置在__________。
(2)下列关于实验的叙述中,错误的是__________。
A.冷凝管的冷水应该从b进从a出
B.实验开始酎,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置A中应使用锌粉,有利于加快生成H2的速率
D.加入沸石的目的是防止暴沸
(3)若实验中步骤③和④的顺序颠倒,则实验中可能产生的后果是_____________。
(4)蒸馏前,步骤⑤中加入生石灰的作用是____________________。
(5)有学生质疑反应完成后,直接蒸馏得到苯胺的纯度不高,提出以下流程:

苯胺在酸性条件下生成盐酸苯胺被水萃取,在碱性溶液中又被放有机溶剂反萃取,这种萃取——反萃取法简称反萃。实验中反萃的作用是__________;在分液漏斗中进行萃取分液时,应注意不时放气,其目的是____________________。
(6)苯胺还原性强,易被氧化,请配平下列化学方程式的化学计量数。