题目内容
下列粒子的个数之比不是1∶1的是
| A.氘原子中的质子和中子 |
| B.C2H4分子中的质子和电子 |
| C.Na2O2固体中的阴离子和阳离子 |
| D.常温下,pH=7的CH3COOH与CH3COONa混合溶液中的H+与OH- |
C
解析试题分析:A、氘原子中的质子和中子的个数分别是1和1,因此个数之比是1:1,A不正确;B、C2H4分子中的质子和电子的个数均是2×6+4×1=16个,因此个数之比是1:1,B不正确;C、过氧化钠中阴阳离子的个数之比是1:2,C正确;D、常温下,pH=7的CH3COOH与CH3COONa混合溶液中c(H+)=c(OH-),因此溶液中H+与OH-个数之比是1:1,D不正确,答案选C。
考点:考查质子数、中子数、电子数计算;离子结构判断以及溶液pH的计算等

练习册系列答案
相关题目
短周期元素W、X、Y、Z的原子序数依次增大,且原子最外层电子数之和为14。W的原子半径比X的大,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最高的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法正确的是
| A.元素X的最高价氧化物对应的水化物的酸性比Z的弱 |
| B.元素Y、Z的简单离子的电子层结构相同 |
| C.元素W与Z形成的化合物为共价化合物 |
| D.原子半径由大到小的顺序为:r(Z)>r(Y)>r (W) |
已知33As、34Se、35Br位于同一周期,下列关系正确的是
| A.电负性:As>Cl>P | B.热稳定性:HCl>HBr>AsH3 |
| C.第一电离能:Br>Se>As | D.酸性:H3AsO4>H2SO4>H3PO4 |
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4,下列说法正确的是( )
| A.W、X、Y、Z的原子半径大小顺序是:W>X>Y>Z |
| B.Y的最高价氧化物对应水化物的酸性比Z的最高价氧化物对应水化物的酸性更强 |
| C.Y和Z形成的分子的空间构型可能是正四面体 |
| D.工业上用电解熔融的X和Z两元素组成的化合物来制取X的单质 |
下列有关原子结构或元素性质说法正确的是
| A.原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B.基态碳原子的价电子排布图: |
C.基态铜原子的价电子排布图: |
| D.Fe3+的最外层电子排布式为:3s23p63d5 |
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是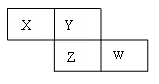
| A.气态氢化物的稳定性:X>Y |
| B.Z元素的氧化物对应的水化物一定是一种强酸 |
| C.X、Y、Z原子半径的大小顺序: X>Y>Z |
| D.X的气态氢化物与W的气态氢化物可以相互反应 |
2012年,IUPAC正式命名了116号元素,但117号元素尚未被正式认定。下列关于 的说法,错误的是
的说法,错误的是
| A.是两种原子 | B.互为同位素 |
| C.中子数分别为176和177 | D.电子数相差1 |
已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
| A.与镓同主族且相邻周期的元素,其原子序数为23或49 |
| B.与镓同周期且相邻主族的元素,其原子序数为30或32 |
| C.原子半径:Br>Ga> Cl> Al |
| D.碱性:KOH>Ga(OH)3>Al(OH)3 |