题目内容
【题目】下列实验操作、现象和结论均正确且存在因果关系的是
选项 | 实验操作和现象 | 实验结论 |
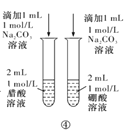
A | 常温下,取浓度均为0.2mol/L的Na2CO3和NaHCO3溶液各2mL于试管中,分别滴加几滴酚酞试液,后者红色更深。 | 相同温度下,CO32-结合H+能力更强 |
B | 向Na2CrO4溶液中滴加浓硫酸,溶液由橙色变成黄色。 | 增大反应物浓度 平衡正向移动 |
C | 向硅酸钠溶液中通入CO2气体,溶液变浑浊 | 酸性:H2CO3>H2SiO3 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
A.AB.BC.CD.D
【答案】C
【解析】
A、常温下,取浓度均为0.2mol/L的Na2CO3和NaHCO3溶液各2mL于试管中,分别滴加几滴酚酞试液,因碳酸钠溶液的碱性更强,所以前者红色更深,A错误;
B、在Na2CrO4溶液中存在下列平衡:2CrO42-+2H+![]() Cr2O72-+H2O,向Na2CrO4溶液中滴加浓硫酸,平衡正向移动,溶液由黄色变成橙色,B错误;
Cr2O72-+H2O,向Na2CrO4溶液中滴加浓硫酸,平衡正向移动,溶液由黄色变成橙色,B错误;
C、向硅酸钠溶液中通入CO2气体,发生反应为SiO32-+CO2+H2O=H2SiO3↓+CO32-,溶液变浑浊,说明碳酸的酸性强于硅酸,C正确;
D、向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液变黄,可能是H2O2将Fe2+氧化,也可能是HNO3将Fe2+氧化,但不能肯定是H2O2将Fe2+氧化,也就不能得出氧化性H2O2>Fe3+,D错误;
答案为C。

练习册系列答案
相关题目