题目内容
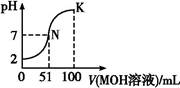
某温度下,体积和pH都相同的盐酸和AlCl3溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )


| A.Al(OH)3的电离方程式为:Al(OH)3=Al3++3OH- |
| B.a点溶液中有: c(H+)+c(Al3+)=c(OH-) +3c(Cl-) |
| C.曲线X表示盐酸稀释过程的pH变化 |
| D.b、c两溶液c(OH-)及c(Cl-)均相等 |
C
试题分析:A. Al(OH)3是弱电解质。在溶液中存在电离平衡。所以其的电离方程式为:Al(OH)3
 Al3++3OH-。错误。B.在任何溶液中都存在电荷守恒。所以在a点溶液中有: c(H+)+3c(Al3+)=c(OH-) +c(Cl-)。错误。C. HCl是强酸,电离产生H+使溶液显酸性,在溶液中不存在电解质的电离平衡。而AlCl3是强酸弱碱盐,水解使溶液显酸性。在水溶液中存在水解平衡。当加水稀释时,强酸的溶液的pH变化较大,盐溶液的pH变化较小。所以曲线X表示盐酸稀释过程的pH变化。正确。D.b、c两点pH相同,则两溶液c(OH-)相同。而c(Cl-)HCl的小于AlCl3的。错误。
Al3++3OH-。错误。B.在任何溶液中都存在电荷守恒。所以在a点溶液中有: c(H+)+3c(Al3+)=c(OH-) +c(Cl-)。错误。C. HCl是强酸,电离产生H+使溶液显酸性,在溶液中不存在电解质的电离平衡。而AlCl3是强酸弱碱盐,水解使溶液显酸性。在水溶液中存在水解平衡。当加水稀释时,强酸的溶液的pH变化较大,盐溶液的pH变化较小。所以曲线X表示盐酸稀释过程的pH变化。正确。D.b、c两点pH相同,则两溶液c(OH-)相同。而c(Cl-)HCl的小于AlCl3的。错误。
练习册系列答案
相关题目
 )
)



 <1
<1