题目内容
【题目】下列有关硅及其化合物的说法正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2![]() CO2↑+Na2SiO3可知,硅酸的酸性强于碳酸
CO2↑+Na2SiO3可知,硅酸的酸性强于碳酸
【答案】C
【解析】
A.玻璃中含有二氧化硅,二氧化硅和HF反应生成SiF4,所以不能用玻璃容器盛放HF,故A错误;
B.硅酸钠属于粘性的物质,能将玻璃塞和试剂瓶瓶口粘结在一起而打不开,故B错误;
C.二氧化硅难溶于水,所以无法用二氧化硅和水直接反应制得,用SiO2制取硅酸,先使二氧化硅与氢氧化钠溶液反应,SiO2+2NaOH=Na2SiO3+H2O,因碳酸酸性强于硅酸且硅酸溶解度较小易沉淀,所以通入CO2,发生Na2SiO3+CO2 +H2O=H2SiO3↓+Na2CO3,制得硅酸,故C正确;
D.酸性强弱的比较只有在没有外界条件干扰化学反应时才能比较,Na2CO3+SiO2![]() CO2+Na2SiO3中反应条件为高温干扰化学反应,所以不能说明硅酸酸性比碳酸酸性强,一般在溶液中强酸可制得弱酸,即硅酸钠溶液中通入CO2,制得硅酸说明碳酸酸性强于硅酸,故D错误;
CO2+Na2SiO3中反应条件为高温干扰化学反应,所以不能说明硅酸酸性比碳酸酸性强,一般在溶液中强酸可制得弱酸,即硅酸钠溶液中通入CO2,制得硅酸说明碳酸酸性强于硅酸,故D错误;
故答案为C。

【题目】醇脱水是制取烯烃的常用方法,实验室以环己醇为原料制取环己烯的实验装置如图所示。
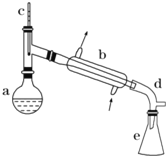
反应的化学方程式:
合成反应: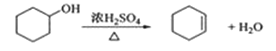
在a中加入40g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯20g。
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
回答下列问题:
(1)装置b的名称是___________
(2)加入碎瓷片的作用是_________
(3)本实验中最容易产生的副反应的化学方程式为______________
(4)分离提纯过程中加入无水氯化钙的目的是________________
(5)本实验所得到的环己烯产率是____(填正确答案标号)
A.41% B.50% C.61% D.70%
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应 温度,化学反应速率加快 |
B | 工业制硫酸过程中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 反应速率减慢 |
D | A.B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可 以改变化学反应速率 |
A.AB.BC.CD.D