题目内容
【题目】COCl2(g)![]() CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
【答案】B
【解析】
由反应COCl2(g)![]() CO(g)+Cl2(g);ΔH>0可知反应为体积增大的反应,且正向为吸热反应,欲提高COCl2转化率,应使平衡正向移动。
CO(g)+Cl2(g);ΔH>0可知反应为体积增大的反应,且正向为吸热反应,欲提高COCl2转化率,应使平衡正向移动。
由反应COCl2(g)![]() CO(g)+Cl2(g);ΔH>0可知反应为体积增大的反应,且正向为吸热反应,欲提高COCl2转化率,应使平衡正向移动;①升高温度,平衡向吸热的方向移动,平成正移;②恒容通入惰性气体,虽增大了压强,但反应中各物质的浓度不变,平衡不移动;③增加CO的浓度,增加生成物的浓度,平衡逆向移动;④减小压强,平衡向体积增大的方向移动,平衡正移;⑤加催化剂,能使反应速率加快,平衡不移动;⑥恒压通入惰性气体,相当于增大体积、减小压强,平衡向体积增大的方向移动,平衡正移;故能提高COCl2转化率的是①④⑥;答案选B。
CO(g)+Cl2(g);ΔH>0可知反应为体积增大的反应,且正向为吸热反应,欲提高COCl2转化率,应使平衡正向移动;①升高温度,平衡向吸热的方向移动,平成正移;②恒容通入惰性气体,虽增大了压强,但反应中各物质的浓度不变,平衡不移动;③增加CO的浓度,增加生成物的浓度,平衡逆向移动;④减小压强,平衡向体积增大的方向移动,平衡正移;⑤加催化剂,能使反应速率加快,平衡不移动;⑥恒压通入惰性气体,相当于增大体积、减小压强,平衡向体积增大的方向移动,平衡正移;故能提高COCl2转化率的是①④⑥;答案选B。
改变的条件(其他条件不变) | 化学平衡移动的方向 | ||
浓度 | 增大反应物浓度或减小生成物浓度 | 向正反应方向移动 | |
减小反应物浓度或增大生成物浓度 | 向逆反应方向移动 | ||
压强(对有气体参加的反应) | 反应前后气体体积改变 | 增大压强 | 向气体分子总数减小的方向移动 |
减小压强 | 向气体分子总数增大的方向移动 | ||
反应前后气体体积不变 | 改变压强 | 平衡不移动 | |
温度 | 升高温度 | 向吸热反应方向移动 | |
降低温度 | 向放热反应方向移动 | ||
催化剂 | 同等程度改变v正、v逆,平衡不移动 | ||

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验方案不能达到实验目的的是
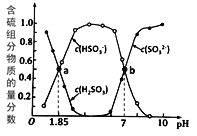
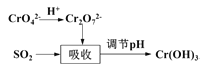
编号 | 实验目的 | 实验方案 |
A | 探究催化剂对 | 两支试管中均盛有 |
B | 探究 | 向盛有 |
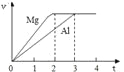
C | 比较 | 两支试管中分别放入已除去氧化膜、大小相同的镁条和铝条,再各加入 |
D | 制取并纯化氢气 | 向稀盐酸中加入纯锌粒,将生成的气体依次通过浓硫酸、 |
A.AB.BC.CD.D