题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(2)D的氢化物比C的氢化物的沸点_____(填"高"或"低"),原因____________。
(3)E元素在周期表的位置是______________。
(4) 画出D的核外电子排布图_________________________________________,这样排布遵循了______________原理、____________原理和____________规则。
(5)用电子式表示B的硫化物的形成过程:______________________________。
【答案】F F 高 氨气分子间能形成氢键 第四周期第Ⅷ族  能量最低 泡利不相容 洪特
能量最低 泡利不相容 洪特 ![]()
【解析】
A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,则B为Na;C的最外层有三个成单电子,则C的3p能级有3个电子,C为P元素;C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,则E的核外电子排布式为1s22s22p63s23p63d64s2,E为Fe元素。依此解答该题。
(1) D为N元素,它位于元素周期表的第二周期,F的非金属性最强,所以第一电离能最大的元素是F,电负性最大的元素是F。答案为:F;F;
(2)D的氢化物为NH3,C的氢化物为PH3,NH3分子间能形成氢键,而PH3分子间不形成氢键,氢键的存在,增大了氨气分子间的作用力,使其沸点升高,所以NH3的沸点比PH3的沸点高,原因是氨气分子间能形成氢键。答案为:高;氨气分子间能形成氢键;
(3)E为Fe,核外电子排布式为1s22s22p63s23p63d64s2,在周期表的位置是第四周期第Ⅷ族。答案为:第四周期第Ⅷ族;
(4) D为N元素,电子排布式为1s22s22p3,核外电子排布图为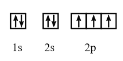 ,这样排布遵循了能量最低原理、泡利不相容原理和洪特规则。答案为:
,这样排布遵循了能量最低原理、泡利不相容原理和洪特规则。答案为: ;能量最低;泡利不相容;洪特;
;能量最低;泡利不相容;洪特;
(5)B为钠,与硫反应生成Na2S,电子式表示B的硫化物的形成过程: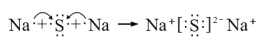 。答案为:
。答案为:![]() 。
。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案