题目内容
【题目】“烟气脱硫”是环境治理的重要工程,两种常见脱硫方法如下。回答相关问题:
方法I:用亚硫酸盐吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数与溶液pH的变化关系如图所示。
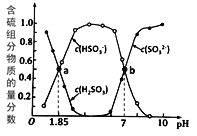
(1)若选用 (NH4)2SO3作为吸收液(已知NH3·H2O 的电离常数Kb=1.74×10-5):
①H2SO3的pKa1=________( pKa1 = -lgKa1);
②(NH4)2SO3溶液呈________(填“酸性”、“碱性”或“中性”),理由是________________;
③图中b点溶液中n(HSO3- ) : n(NH4+) =_________。
(2)若选用0.1mol/L 的Na2SO3作为吸收液,吸收过程中,下列有关粒子浓度关系一定正确的是(忽略溶液体积的变化)_________。
A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-)
B.NaHSO3溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
C.当吸收液呈中性时:2c(SO32-)+c(HSO3-)=0.2mol/L
D.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
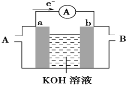
方法II:用含铬废水吸收烟气中的SO2。吸收原理如图所示:
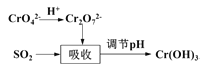
(3)“吸收”中反应的离子方程式为____________________
(4)欲使废水中的铬元素完全转化为Cr(OH)3沉淀,应调节pH的范围为____。(常温下Ksp[Cr(OH)3]=1.0×10-32)
【答案】1.85 碱性 SO32-的水解程度大于NH4+的水解程度 1:3 BC 3SO2+Cr2O72-+2H+ =2Cr3++3SO42-+H2O ≥5
【解析】
(1)①H2SO3的第一步电离平衡常数Ka1=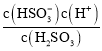 ,据此结合图像计算;
,据此结合图像计算;
②(NH4)2SO3溶液中存在铵根的水解和亚硫酸根的水解,若铵根水解程度大则显酸性,若亚硫酸根水解程度大则显碱性;
③结合电荷守恒和图像进行判断;
(2)A.Na2SO3作为吸收液,溶液中存在第一步水解:![]() ,第二步水解:
,第二步水解:![]() ,且一步水解程度远大于第二步水解;
,且一步水解程度远大于第二步水解;
B.NaHSO3溶液中存在电离平衡:![]() ,和水解平衡:
,和水解平衡:![]() ,据此进行分析;
,据此进行分析;
C.根据电荷守恒进行分析;
D.根据电荷守恒进行分析;
(3)根据产物可知该过程中Cr2O72-被还原成Cr3+,二氧化硫做还原剂;
(4)当离子浓度![]() ,可认为该离子完全沉淀;然后根据Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)进行计算;
,可认为该离子完全沉淀;然后根据Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)进行计算;
(1)①Ka1=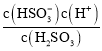 ,根据图像可知当pH=1.85时,n(HSO3- ) =n(H2SO3),也即c(HSO3- ) =c(H2SO3),所以Ka1=10-1.85,则pKa1=1.85,故答案为:1.85;
,根据图像可知当pH=1.85时,n(HSO3- ) =n(H2SO3),也即c(HSO3- ) =c(H2SO3),所以Ka1=10-1.85,则pKa1=1.85,故答案为:1.85;
②NH3·H2O 的电离常数Kb=1.74×10-5,则铵根的水解平衡常数为![]() ,亚硫酸根的水解平衡常数
,亚硫酸根的水解平衡常数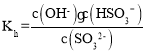 根据图像可知当pH=7时,n(HSO3-)=n(SO32-),即c(HSO3-)=c(SO32-),所以亚硫酸根的水解平衡常数为1×10-7,大于铵根的水解平衡常数,所以亚硫酸根的水解程度大,溶液显碱性,故答案为:碱性;SO32-的水解程度大于NH4+的水解程度;
根据图像可知当pH=7时,n(HSO3-)=n(SO32-),即c(HSO3-)=c(SO32-),所以亚硫酸根的水解平衡常数为1×10-7,大于铵根的水解平衡常数,所以亚硫酸根的水解程度大,溶液显碱性,故答案为:碱性;SO32-的水解程度大于NH4+的水解程度;
③b点溶液呈中性,即c(H+)=c(OH-),同时溶液中存在电荷守恒2c(SO32-)+c(HSO3-)+ c(OH-)= c(NH4+)+ c(H+),则有2c(SO32-)+c(HSO3-)= c(NH4+),根据图像可知该点c(HSO3-)=c(SO32-),所以有3c(HSO3-)= c(NH4+),所以n(HSO3- ) : n(NH4+) =1:3;
(2)A.根据分析可知,在吸收二氧化硫之前,H2SO3是水解产生的,且为更为微弱的第二步水解产生,所以此时c(HSO3-)>c(H2SO3),故A错误;
B.NaHSO3溶液中存在硫酸氢根的电离和水解,根据图像可知硫酸氢钠水溶液显酸性即电离大于水解,所以c(SO32-)>c(H2SO3),溶液中存在c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故B正确;
C.吸收至中性时存在电荷守恒2c(SO32-)+c(HSO3-)+ c(OH-)= c(Na+)+ c(H+),且此时c(H+)=c(OH-),所以有2c(SO32-)+c(HSO3-)=c(Na+)=0.2mol/L,故C正确;
D.当吸收溶液呈酸性时,溶液中有电荷守恒:2c(SO32-)+c(HSO3-)+ c(OH-)= c(Na+)+ c(H+),溶液显酸性则c(H+)<c(OH-),所以2c(SO32-)+c(HSO3-)>c(Na+),根据图像可知当溶液呈酸性时c(H2SO3)> c(SO32-)是,所以c(SO32-)+c(HSO3-)+c(H2SO3)> c(Na+),故D错误;
故答案为:BC;
(3)根据产物可知该过程中Cr2O72-被还原成Cr3+,二氧化硫做还原剂被氧化成硫酸根,根据电子守恒和元素守恒可得方程式为:3SO2+Cr2O72-+2H+ =2Cr3++3SO42-+H2O;故答案为:3SO2+Cr2O72-+2H+ =2Cr3++3SO42-+H2O;
(4)设铬元素完全转化为Cr(OH)3沉淀时溶液中的c(OH-)=amol/L,Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)=1×10-5×a3=1.0×10-32,解得a=1.0×10-9 amol/L,此时pH值为5,所以欲使废水中的铬元素完全转化为Cr(OH)3沉淀,应调节pH的范围为≥5,故答案为:≥5。