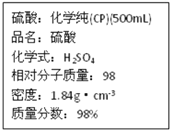
题目内容
【题目】(1)24.8 g Na2R含有Na+ 0.8 mol则R的摩尔质量为_________________。
(2)质量都为ag的镁和铝,物质的量之比为___________;将它们分别放入适量的盐酸溶液中恰好完全反应,则消耗的HCl的物质的量之比为___________。
(3)在标准状况下,CO和CO2混合气体的质量为36 g,体积为22.4 L,则其中CO2所占的体积为_________,CO所占的质量为_________。
【答案】16 g/mol9︰83︰411.2 L14 g
【解析】
(1)24.8g Na2R 含有Na+0.8mol,则Na2R的物质的量为0.4mol,Na2R的摩尔质量=![]() =62g/mol,结合钠元素的摩尔质量计算R的摩尔质量;(2)根据n=
=62g/mol,结合钠元素的摩尔质量计算R的摩尔质量;(2)根据n=![]() 计算其物质的量之比;根据金属和酸之间的关系式计算;(3)混合气体的物质的量=
计算其物质的量之比;根据金属和酸之间的关系式计算;(3)混合气体的物质的量=![]() =1mol,根据质量、物质的量列方程式计算。
=1mol,根据质量、物质的量列方程式计算。
(1)24.8g Na2R 含有Na+0.8mol,则Na2R的物质的量为0.4mol,Na2R的摩尔质量=![]() =62g/mol,则R的摩尔质量=62g/mol-23g/mol×2=16g/mol;
=62g/mol,则R的摩尔质量=62g/mol-23g/mol×2=16g/mol;
(2)根据n=![]() 知,等质量ag时,镁和铝的物质的量之比=
知,等质量ag时,镁和铝的物质的量之比=![]() :
:![]() =9:8;
=9:8;
根据Mg---2HCl、Al---3HCl知,消耗酸的物质的量之比=(9×2):(8×3)=3:4;
(3)混合气体的物质的量=![]() =1mol,设CO和CO2的物质的量分别是xmol、ymol,
=1mol,设CO和CO2的物质的量分别是xmol、ymol,![]() ,解得x=0.5,y=0.5,二氧化碳体积=0.5mol×22.4L/mol=11.2L,CO的质量=28g/mol×0.5mol=14g。
,解得x=0.5,y=0.5,二氧化碳体积=0.5mol×22.4L/mol=11.2L,CO的质量=28g/mol×0.5mol=14g。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】下列有机物的鉴别中,所选用的试剂及产生的现象不完全正确的是( )
选项 | 有机物 | 试剂 | 现象 |
A | 乙烯 | 溴水 | 橙色褪去 |
B | 葡萄糖 | 新制氢氧化铜悬浊液 | 出现红色沉淀 |
C | 淀粉 | 碘水 | 出现蓝色沉淀 |
D | 蛋白质 | 浓硝酸 | 呈黄色 |
A.AB.BC.CD.D