题目内容
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
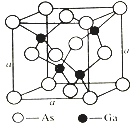
①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________。
【答案】 1s22s22p63s23p63d104s24p3 NH3>AsH3>PH3 bc 共价键(或极性键)、配位键 正四面体 Ga4As4 5.37g·cm-3
【解析】(1). 砷是33号元素,基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2). 因氨气分子之间存在氢键,所以氨气在三种氢化物中沸点最高,AsH3和PH3的组成和结构相似,相对分子质量越大,分子间作用力越大,氢化物的沸点越高,所以氢化物的沸点从高到低的顺序为:NH3>AsH3>PH3,故答案为:NH3>AsH3>PH3;
(3). a. 同一周期的元素,随原子序数增大,元素的电负性增大,所以电负性As>Ga,故a错误;b. SiC与GaAs中原子总数相等,价电子数相同,所以互为等电子体,故b正确;c. 同一周期的元素,随原子序数增大,元素的第一电离能呈增大趋势,As元素的价电子排布式为4s24p3,是一种半充满的稳定结构,第一电离能较大,所以第一电离能:As>Se>Ga,故c正确;答案为:bc;
(4). ①. 由GaAs的晶胞结构和晶体熔点可知,晶胞中砷与镓原子之间含有共价键,由于Ga原子最外层只有3个电子,而每个Ga原子与 4个As原子成键,因此其中一个键是配位键,故答案为:共价键(或极性键)、配位键;
②. 由晶胞结构可知,每个Ga原子与 4个As原子成键,一个Ga原子周围所有距离最近且相等的4个As原子构成正四面体,故答案为:正四面体;
③. Ga原子位于体内,个数为4,As原子位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,所以一个晶胞的组成为Ga4As4,故答案为:Ga4As4;
=4,所以一个晶胞的组成为Ga4As4,故答案为:Ga4As4;
④. 由上述分析可知,一个晶胞的组成为Ga4As4,则该晶胞的密度为ρ=![]() =5.37g·cm-3,故答案为:5.37g·cm-3。
=5.37g·cm-3,故答案为:5.37g·cm-3。

