题目内容
12. 研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
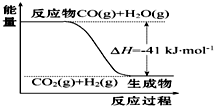
研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
①反应的热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.
②已知:C(s)+H2O(g)═CO(g)+H2(g)△H=+131kJ•mol-1,
则C(s)+CO2(g)═2CO(g)△H=+172kJ/mol.
(2)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知:N≡N键的键能是948.9kJ•mol-1,H-H键的键能是436.0kJ•mol-1;N-H键的键能是391.55 kJ•mol-1.
①$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=-46.2KJ/moL.
②N2、H2、NH3 三种分子的稳定性由强到弱的顺序是N2>H2>NH3.
分析 (1)①依据图象分析反应是放热反应,焓变为-41KJ/mol,依据热化学方程式的书写方法写出;
②依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(2)①反应的焓变△H=反应物键能总和-生成物键能总和计算;
②根据键能越大,分子越稳定.
解答 解:(1)①图象分析反应是放热反应,焓变为-41KJ/mol,标注物质狙击状态和对应反应焓变得到热化学方程式为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1,故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1;
②(1)CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1;
(2)C(s)+H2O(g)═CO(g)+H2(g)△H=+131kJ•mol-1
依据盖斯定律(2)-(1)得到:C(s)+CO2(g)═2CO(g)△H═+172kJ/mol,
故答案为:+172kJ/mol;
(2)①N≡N键的键能是948.9kJ•mol-1,H-H键的键能是436.0kJ•mol-1; N-H键的键能是391.55kJ•mol-1.则$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=反应物键能总和-生成物键能总和=$\frac{1}{2}$×948.9kJ•mol-1 +$\frac{3}{2}$×436.0kJ•mol-1 -3×391.55kJ•mol-1=-46.2KJ/mol,
故答案为:-46.2 KJ/moL;
②键能越大,分子越稳定,又N≡N键的键能是948.9kJ•mol-1,H-H键的键能是436.0kJ•mol-1; N-H键的键能是391.55kJ•mol-1,所以N2、H2、NH3 三种分子的稳定性由强到弱的顺序是N2>H2>NH3,故答案为:N2>H2>NH3.
点评 本题考查了热化学方程式书写方法和注意问题,注意键能计算焓变的方法,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. |  萃取碘水中碘 | B. |  收集氢气 | C. |  稀释浓硫酸 | D. |  向试管中加液体 |
| A. | H2S+H2SO4(浓) | B. | Cu+H2SO4(浓) | C. | C+H2SO4 (浓) | D. | CuO+H2SO4 (浓) |
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ•mol-1) | 414.4 | 615.3 | 347.4 | 435.3 |
| A. | 125.6kJ•mol-1 | B. | -125.6kJ•mol-1 | C. | 46.1kJ•mol-1 | D. | -46.1kJ•mol-1 |
| A. | 地沟油不能食用,但可以在循环经济中发挥作用 | |
| B. | 多用电子邮件、QQ、飞信等即时通讯工具,少用传真打印机,属于“低碳生活”方式 | |
| C. | 实施绿化工程,可以有效地防治PM2.5污染 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱也不会“断路” |
| 选项 | 操作及现象 | 溶液 |
| A | 通入SO2,溶液不变浑浊,再通CO2,溶液仍不变浑浊 | BaCl2溶液 |
| B | 通入足量CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| C | 通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| D | 通入等物质的量的SO2和Cl2混合气体,溶液无变化,再通SO2,溶液褪色 | 品红溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 冰毒、甘油 | B. | 尼古丁、维生素 | C. | 味精、可卡因 | D. | 吗啡、大麻 |

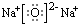 (填写电子式).
(填写电子式).