题目内容
16.下列说法中正确的是( )| A. | 只有不法商贩才使用食品添加剂 | |
| B. | 凡是食品添加剂均对人体有害 | |
| C. | 在限量范围内使用食品添加剂不会对人体造成危害 | |
| D. | 味精是食品添加剂,而碘盐中的“碘”不是添加剂 |
分析 A.食品添加剂具有改善食品特征、防止食品腐败变质、提高食品质量稳定性的作用;
B.食品添加剂确实提高了现代食品的品质,副作用也是显而易见的,食品添加剂可以合理使用;
C.在规定范围内使用食品添加剂,一般对人体是无害的;
D.食盐加碘,预防地方性甲状腺肿,添加人体营养元素.
解答 解:A.为改善食品特征、防止食品腐败变质、提高食品质量稳定性,正规厂家也会使用食品添加剂,故A错误;
B.食品添加剂是为改善食品色、香、味等品质,以及为防腐和加工工艺的需要而加入食品中的化合物质或者天然物质,在规定范围内使用食品添加剂,一般认为对人体健康无害,故B错误;
C.在规定范围内使用食品添加剂,一般对人体是无害的,违反规定,将一些不能作为食品添加剂的物质当做食品添加剂,或者超量使用食品添加剂,都会损害人体健康,故C正确;
D.碘盐中的“碘”属于添加剂,故D错误.
故选C.
点评 本题考查食品添加剂,难度不大,注意了解食品添加剂对人体健康的影响.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
2.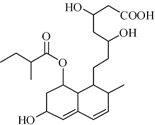 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 1mol该物质与1molBr2发生加成反应,产物有2种 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与1molNaOH反应 |
7.连二亚硫酸钠(Na2S2O4),是印刷工业中重要的还原剂.某小组进行如下实验:
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】
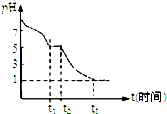
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
(3)资料显示:保险粉、H2O2均可用于纸浆漂白.写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:S2O42-+3H2O2=2SO42-+2H++2H2O_.
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】

(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
4.下列关于影响化学反应速率因素的解释不正确的是( )
| A. | 若仅加入催化剂,改变反应途径→降低反应所需要的活化能→活化分子数增多→有效碰撞次数增多→化学反应速率增大 | |
| B. | 若仅增大反应物浓度,单位体积活化分子数增多→单位体积有效碰撞次数增多→化学反应速率增大 | |
| C. | 若仅升高温度,活化分子百分数增加且分子间的碰撞频率提高→有效碰撞次数增多→化学反应速率增大 | |
| D. | 若仅加大体系压强,体积变小→活化分子百分数增加→单位体积的活化分子数目增加→有效碰撞次数增多→化学反应速率增大 |
11.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol,
H2(g)+Br2(g)═2HBr(g)△H=-Q2kJ/mol,
有关上述反应的叙述正确的是( )
H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol,
H2(g)+Br2(g)═2HBr(g)△H=-Q2kJ/mol,
有关上述反应的叙述正确的是( )
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1molHCl气体时放出Q1热量 | |
| D. | 如果Q1>Q2,断开Cl-Cl键需要的能量比断开Br-Br键需要的能量低 |
8.常温下,在10mL 0.2mol/L氨水中,滴入0.2mol/L的稀盐酸,使溶液的pH=7.则下列说法正确的是( )
| A. | 加入盐酸的体积大于10 mL | B. | c(NH4+)=c(Cl-) | ||
| C. | 加入盐酸的体积等于10 mL | D. | c(NH4+)<c(Cl-) |
5.在一定条件下,pH相同的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol.L-1 和1.0×10-bmol.L-1,在此温度下,下列说法正确的( )
| A. | a<b | B. | a=b | ||
| C. | 水的离子积为1.0×10-(7+a) | D. | 水的离子积为1.0×10-(b+a) |