题目内容
【题目】回答下列问题
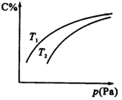
(1)反应mA(g)+nB(g)![]() pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
压强/Pa | 2×105 | 4×105 | 8×105 |
c(A)/mol·L-1 | 0.10 | 0.20 | 0.44 |
分析表中数据可知:m、n、p的关系是:m+n______p(填>、=或<)。当压强从4×105 Pa增加到8×105Pa时,该反应的化学平衡________(填“向左”“向右”或“不”)移动,可能的原因是_____________________________________________。
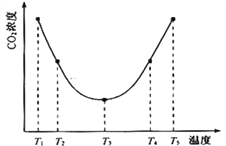
(2)利用反应:(NH4)2CO3(aq)+H2O(l)+ CO2(g)![]() 2NH4HCO3(aq) △H = akJ/mol 可以用(NH4)2CO3溶液捕获CO2以减小温室效应。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),测定容器中CO2气体的浓度。在其它实验条件不变、时间间隔相同时,测得容器中CO2气体浓度随温度的变化趋势图如下:则△H______0(填>、=或<)。在T3前后容器内CO2气体浓度呈现如图变化趋势的原因是___________________________。
2NH4HCO3(aq) △H = akJ/mol 可以用(NH4)2CO3溶液捕获CO2以减小温室效应。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),测定容器中CO2气体的浓度。在其它实验条件不变、时间间隔相同时,测得容器中CO2气体浓度随温度的变化趋势图如下:则△H______0(填>、=或<)。在T3前后容器内CO2气体浓度呈现如图变化趋势的原因是___________________________。
(3)某温度下,水的离子积KW = 1.0×10-12,现将100体积pH=a的H2SO4溶液和1体积pH=b的NaOH溶液混合使之呈中性,则a + b = __________。
【答案】 = 向左 反应物B在此压强下已由气态转化为液态 < 在T3前反应未达平衡,升高温度化学反应速率加快,CO2的捕获量增加,T3后反应达平衡,升高温度化学平衡逆向移动,CO2的捕获量减小 14
【解析】试题分析:根据表格数据,压强从2×105增大到4×105,体积缩小一倍,c(A)从0.2增大到0.2,也增大一倍,说明平衡没移动;当压强从4×105 Pa增加到8×105Pa时,c(A)从0.2增大到0.44,浓度的变化大于2倍,说明平衡逆向移动;(2)由图可知,当温度为T3时,可逆反应达到平衡状态,温度升高,CO2的浓度逐渐增大,说明平衡逆向移动;②在T1~T3区间,此时可逆反应未达到平衡,温度升高,化学反应速率加快,反应正向进行,CO2的捕获量随温度的升高而提高 。(3)溶液混合后呈中性,根据![]() 计算;
计算;
解析:根据表格数据,压强从2×105增大到4×105,体积缩小一倍,c(A)从0.2增大到0.2,也增大一倍,说明平衡没移动,加压平衡不移动,说明气体系数和不变,故m+n=p;当压强从4×105 Pa增加到8×105Pa时,c(A)从0.2增大到0.44,浓度的变化大于2倍,说明平衡逆向移动,说明气体系数和不相同,则反应物B在此压强下已由气态转化为液态;(2)由图可知,当温度为T3时,可逆反应达到平衡状态,温度升高,CO2的浓度逐渐增大,说明平衡逆向移动,则△H<0;②在T3前反应未达平衡,升高温度化学反应速率加快,CO2的捕获量增加,T3后反应达平衡,升高温度化学平衡逆向移动,CO2的捕获量减小。(3)KW = 1.0×10-12, pH=a的H2SO4溶液中![]() 、pH=b的NaOH溶液
、pH=b的NaOH溶液![]() ;
; ![]() ,
, ![]() ;则a + b =14。
;则a + b =14。

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】硼酸(H3BO3)溶液中存在反应:H3BO3(aq)+H2O(l) ![]() [B(OH)4]-(aq)+H+(aq)。结合下表,下列说法正确的是( )
[B(OH)4]-(aq)+H+(aq)。结合下表,下列说法正确的是( )
化学式 | 硼酸 | 碳酸 | 醋酸 |
电离常数(298 K) | K=5.7×10-10 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
A. 将少量醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
B. 往碳酸钠溶液加入过量硼酸,没有明显变化,说明没有发生反应
C. 硼酸是三元弱酸,酸性比碳酸强
D. 等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者