题目内容
20.同一周期的X、Y、Z三种元素,其最高价氧化物对应水化物的酸性强弱顺序为:HZO4>H2YO4>H3XO4,则下列判断正确的是( )| A. | 单质的氧化性为:Z>Y>X | B. | 非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:XH3>H2Y>HZ | D. | 原子半径:Z>Y>X |
分析 同周期元素从左到右,元素非金属性增强,元素最高价氧化物对应水化物的酸性逐渐增强、单质氧化性增强、氢化物稳定性增强、原子半径逐渐减小.
解答 解:非金属性越强,最高价氧化物对应水化物的酸性越强,最高价氧化物对应水化物的酸性是:HZO4>H2YO4>H3XO4,则非金属性Z>Y>X;
A.非金属性越强,单质氧化物越强,故单质氧化性:Z>Y>X,故A正确;
B.最高价氧化物对应水化物的酸性是:HZO4>H2YO4>H3XO4,则非金属性Z>Y>X,故B错误;
C.非金属性越强,氢化物越稳定,由于非金属性Z>Y>X,所以气态氢化物的稳定性:HZ>H2Y>XH3,故C错误;
D.同周期从左到右非金属性增强,原子半径逐渐减小,所以原子半径:Z<Y<X,故D错误;
故选A.
点评 本题考查元素周期律知识,题目难度不大,注意对元素周期律的理解及应用,知道非金属的非金属性与氢化物的稳定性、最高价氧化物的水化物酸性强弱关系,熟练掌握同一周期、同一主族元素性质递变规律.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
8.下列说法不正确的是( )
| A. | 烃是指仅含碳和氢两种元素的有机物 | |
| B. | 含碳化合物都属有机物 | |
| C. | 分子里含有苯环的碳氢化合物属于芳香烃 | |
| D. | 通常所说的“白色污染”是指聚乙烯等白色塑料垃圾 |
15.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 增加X的物质的量,该反应的化学反应速率一定加快 |
5.在标准状况下,相同质量的下列气体中体积最大的是( )
| A. | NO | B. | CO2 | C. | N2 | D. | O2 |
12.下列实验事实陈述ⅠⅡ正确并且有因果关系的是( )
| Ⅰ操作 | Ⅱ结论 | |
| A | 滴加BaC12溶液生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| D | 滴加氯水和CC14,振荡、静置.下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
10.如图是CO2电催化还原为CH4的工作原理示意图.正确的是( )
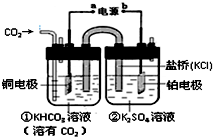

| A. | 该装置为原电池,其中a为正极 | |
| B. | 铜电极的电极反应式为:CO2+8H++8e-$?_{加热}^{催化剂}$CH4+2H2O | |
| C. | 反应开始后,电子从a极流出至铜电极,经电解质溶液到铂电极最后流回至b极 | |
| D. | 一段时间后,②池中溶液的pH一定下降 |
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁. ;
; ,工业合成路线如下:
,工业合成路线如下:

 (R-代表烃基)
(R-代表烃基) 、
、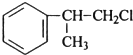 ;
;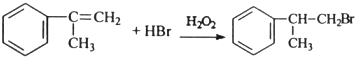 ;
; .
.