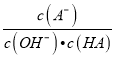��Ŀ����
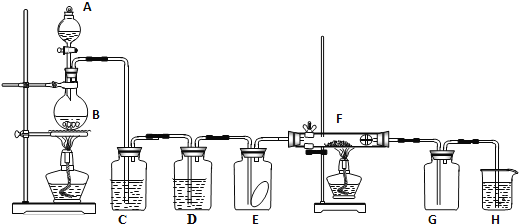
����Ŀ������һ��������Na2O���ʵ�Na2O2����������ͼ��ʵ��װ�òⶨNa2O2�����Ĵ��ȡ�(�ɹ�ѡ�õķ�Ӧ��ֻ��CaCO3���塢6 mol��L��1���ᡢ6 mol��L��1���������ˮ)
�ش��������⣺
(1)ʵ��ǰ������װ�õ������ԡ��������Ӻú���________�м�������ˮ���ر�A�з�Һ©�����ź����Թܣ�������________��˵��װ�������Ժá�
(2)װ��A��Һ���Լ�ѡ��������������ᣬ������__________________________________________��
(3)װ��B��������___________��װ��C��������______________��װ��E�м�ʯ�ҵ�������__________________��
(4)װ��D�з�����Ӧ��������Ļ�ѧ����ʽ��_____________________________________________��
(5)����ʼʱ�����Ʒ������Ϊ2.0 g����Ӧ���������������Ϊ224 mL(��״��)����Na2O2�����Ĵ���Ϊ_________��
���𰸡�F F�г�������ˮ������ ������CaCO3���巴Ӧ����CaSO4����ˮ���Ḳ����CaCO3������棬ʹ��Ӧ���ܳ������� ��ȥ�����е�HCl�� �������� ����װ��D�з�Ӧʣ���CO2 2Na2O2��2CO2===2Na2CO3��O2 78%
��������
ʵ��ԭ����ͨ���ⶨCO2��Na2O2��Ӧ���������������������������Na2O2������������ȡCO2�����õ���CaCO3������ķ�Ӧ������������лӷ��ԣ������ȡ��CO2�б�Ȼ����HCl������ͨ������NaHCO3��Һ��ȥ��װ��CΪ����CO2��װ��EΪ��ȥO2�к��е�CO2�����ݷ�Ӧ2Na2O2��2CO2===2Na2CO3��O2��Na2O2��O2�Ĺ�ϵ����������O2����������Ʒ��Na2O2�����������ȣ�n(O2)��0.01 mol��n(Na2O2)��0.01 mol��2��0.02 mol��w(Na2O2)����100%��78%��
(1) ���װ�õ������ԣ�Ӧ��װ�����Ӻ�֮�رջ������ˮ���װ���еĿ�����Ȼ����ü��ȷ�ʹװ��������ѹǿ����ͨ���ų�������γ�Һ���жϡ������������Ӻú���F�м�������ˮ���ر�A�з�Һ©�����ź����Թܣ�������F�г�������ˮ��������˵��װ�������Ժá�
�ʴ�Ϊ��F ��F�г�������ˮ��������
(2) ʵ��������CaCO3�����ᷴӦ��ȡCO2��������H2SO4��ԭ����H2SO4��CaCO3��Ӧ���ɵ�CaSO4�ܽ�Ƚ�С���Ḳ����CaCO3������棬��ֹ��Ӧ�ļ������С�
�ʴ�Ϊ��������CaCO3���巴Ӧ����CaSO4����ˮ���Ḳ����CaCO3������棬ʹ��Ӧ���ܳ������У�
(3) ̼��ƺ����ᷴӦ���ɵĶ�����̼�����к����Ȼ������壬�����ñ���̼����������ȥ��Ũ���������ˮ�ԣ����Խ�������̼���װ��E�м�ʯ�ҵ����������ն�����̼����ֹ�����������������ɸ��ţ�
�ʴ�Ϊ����ȥ�����е�HCl���������壻����װ��D�з�Ӧʣ��Ķ�����̼��
(4) װ��D���ǹ������ƺͶ�����̼������̼���ƺ������������ƺͶ�����̼��Ӧ����̼���ƣ�����������Ļ�ѧ����ʽΪ��2Na2O2��2CO2===2Na2CO3��O2��
�ʴ�Ϊ��2Na2O2��2CO2===2Na2CO3��O2��
(5)���ݷ�Ӧ2Na2O2��2CO2===2Na2CO3��O2����Ӧ���������������Ϊ224mL����״�����������ɵ���������0.01mol���������Ƶ����ʵ���Ϊ0.02mol��
�������ƵĴ���=![]() ��100%=78%��
��100%=78%��
�ʴ�Ϊ��78%��

 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д� Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�����Ŀ��SO2�㷺����ҽҩ�����Ṥҵ�������շ����е�SO2�������·�����
������ | �ü�ʽ������Al2(SO4)x(OH)y��Һ���ո���SO2 |
������ | ��Fe2+��Fe3+���£��ÿ���(O2)��SO2����ΪH2SO4 |
��1��������Ĺ������¡�
�� �Ʊ�Al2(SO4)x(OH)y
��Al2(SO4)3��Һ�м���CaO��ĩ����pH��3.6�� CaO������֮һ�Ǵٽ�_______ˮ�⣨�����ӷ��ţ���ͬ�������dz���һ����_______��
�� ���գ�Al2(SO4)x(OH)y����SO2��IJ�����_______��д��ѧʽ����
�� ���������Ȣ��в������SO2��Al2(SO4)x(OH)y������
��2���������У���Fe2+���£�SO2��O2��H2O����H2SO4�Ļ�ѧ����ʽ��______��
��3���������У�Fe2+�Ĵ����̿ɱ�ʾ���£�
����2 Fe2++ SO2+ O2=2 Fe3++ SO42-
���� ����
�� д���������ӷ���ʽ��______��
�� ����ʵ�鷽����֤ʵ���������̡���ʵ�鷽������������
a����FeCl2��Һ����KSCN���ޱ仯
b����FeCl2��Һͨ������SO2������KSCN����ɫ��졣
c��ȡb����Һ��_______��
��4���������У����������õζ����ⶨ�����в���SO2�ĺ�������V L���ѻ���Ϊ��״���������е�SO2��1%��H2O2��ȫ���գ�����Һ����ͼ��ʾװ�õζ���������a mL c mol/L NaOH��Һ��

�� H2O2����SO2�Ļ�ѧ����ʽ_______��
�� �����в���SO2���������Ϊ_______��