题目内容
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用之一是促进_______水解(填离子符号,下同),二是沉淀一部分_______。
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是_______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,_______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

① H2O2氧化SO2的化学方程式_______。
② 废气中残留SO2的体积分数为_______。
【答案】 ![]()
![]()
![]()
![]()
![]()
![]()
![]() 通入
通入![]() ,溶液红色褪去(或变浅)
,溶液红色褪去(或变浅) ![]()
![]()
【解析】(1)①向Al2(SO4)3溶液中加入CaO粉末,氧化钙与水反应生成氢氧化钙,氢氧化钙中和了铝离子水解生成的氢离子,促进铝离子水解,同时生成微溶于水的硫酸钙沉淀,故答案为:![]() ;
; ![]() ;
;
②Al2(SO4)x(OH)y 与二氧化硫反应时,本质为氢氧根离子与二氧化硫反应,生成亚硫酸根离子,因此Al2(SO4)x(OH)y吸收SO2后的产物为![]() ,故答案为:
,故答案为:![]() ;
;
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式为![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]() ;
;
(3)① 根据总反应![]()
![]()
![]() ,用正反应-反应i(2 Fe2++ SO2+ O2=2 Fe3++ SO42-)得:ⅱ的离子方程式为
,用正反应-反应i(2 Fe2++ SO2+ O2=2 Fe3++ SO42-)得:ⅱ的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
②a.向FeCl2溶液滴入KSCN,无变化,说明不存在Fe3+,b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红,说明生成了Fe3+,c.取b中溶液,再通入![]() ,溶液红色褪去,说明Fe3+被二氧化硫还原生成了Fe2+,说明在反应过程中Fe2+是催化剂,故答案为:通入
,溶液红色褪去,说明Fe3+被二氧化硫还原生成了Fe2+,说明在反应过程中Fe2+是催化剂,故答案为:通入![]() ,溶液红色褪去;
,溶液红色褪去;
(4)① H2O2氧化SO2反应生成硫酸,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
②氢氧化钠的物质的量=ac×10-3mol,说明生成的硫酸为![]() ×ac×10-3mol,废气中含有的二氧化硫为
×ac×10-3mol,废气中含有的二氧化硫为![]() ×ac×10-3mol,废气中残留SO2的体积分数=
×ac×10-3mol,废气中残留SO2的体积分数=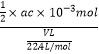 ×100%=
×100%=![]() ,故答案为:
,故答案为:![]() 。
。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案