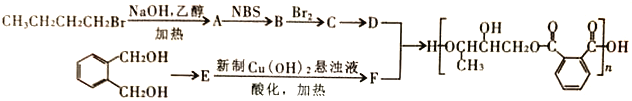
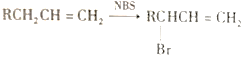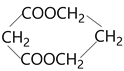题目内容
【题目】有Fe2+﹑NO3-﹑NH4+﹑Fe3+、H+- H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A. 若有1mol NO3-参加还原反应,则转移8mole- B. 还原产物为NH4+
C. 氧化剂与还原剂的物质的量之比为8:1 D. 该反应中Fe2+被氧化
【答案】C
【解析】
Fe2+具有还原性,NO3-在酸性条件下具有强氧化性,根据题意可以确定,铁元素的化合价升高,N元素的化合价降低,则发生反应8Fe2++ NO3-+10H+=8 Fe3++ NH4++H2O,据此分析。
Fe2+具有还原性,NO3-在酸性条件下具有强氧化性,根据题意可以确定,铁元素的化合价升高,N元素的化合价降低,则发生反应8Fe2++ NO3-+10H+=8 Fe3++ NH4++H2O。
A、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,所以有1mol NO3-发生还原反应,转移电子数为1mol ![]() [5-(-3)]=8mol,故A正确;
[5-(-3)]=8mol,故A正确;
B、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,NH4+是还原产物,故B正确;
C、由方程式可以知道该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8,故所以C选项是错误的;
D、反应中Fe元素的化合价由+2价升高到+3价,Fe2+被氧化,故D正确;
故答案选C。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】在温度相同、容积均为2L的三个恒容密闭容器中,按不同方式投入反应物,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)△H= -92.4kJ/mol;保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
2NH3(g)△H= -92.4kJ/mol;保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molN2、6molH2 | 2molNH3 |
NH3 的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强 | p1 | p2 | p3 |
反应物转化率 |
|
|
|
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. Q3+92.4![]() =92.4 D.
=92.4 D. ![]() <1
<1
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环,有效降低碳排放。
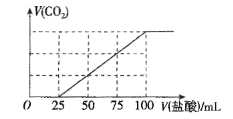
(1)在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
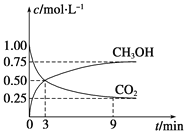
①计算:从0min到3min,H2的平均反应速率v(H2)=_______mol·L-1·min-1,反应至平衡时,放出的热量是_______kJ。
②能说明上述反应达到平衡状态的是________(填编号)。
A.c(CO2) ∶c(CH3OH)=1∶1
B.混合气体的密度不再发生变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③反应达到平衡后,保持其他条件不变,能加快反应速率且使体系中气体的物质的量减少,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
(2)已知A(g)+B(g) ![]() C(g)+D(g) ΔH,反应的平衡常数和温度的关系如下:
C(g)+D(g) ΔH,反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | x | 0.6 | 0.4 |
回答下列问题:
①该反应是_____反应(填“放热”或“吸热”)。
②830℃时,向一个2L的密闭容器中充入0.20mol的A和0.80mol的B,反应至10s时达到平衡,测得A的转化率为80%,计算830℃时,反应的平衡常数x=____。