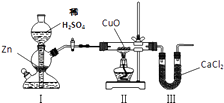
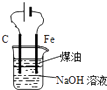
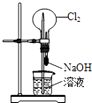
题目内容
【题目】在氢、氮、氯和钠四种元素中:
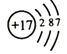
(1)四种元素中最外层电子数最多的原子的结构示意图为 .
(2)由2种元素组成的共价化合物的水溶液显酸性,这种化合物的电子式是;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为 , 四种元素对应的化学性质最稳定的单质的电子式为 .
(3)由两种元素组成的离子化合物,其化学式为 , 由三种元素组成的离子化合物,用电子式表示其形成过程 .
(4)与氯同属卤族元素的各元素的氢化物中稳定性最好的是 , 其稳定的原因是 .
【答案】
(1)
(2)![]() ;
; ![]() ;
; ![]()
(3)NaCl; H?+H?+H?+ ![]() +
+ ![]() →
→ ![]()
(4)HF; H﹣F键键长短,键能大
【解析】解:(1)氢原子核外电子排布是1,有1层,最外层电子数为1;氮原子核外电子排布是2、5,有2层,最外层电子数为5;、氯原子核外电子排布是2、8、7,有3层,最外层电子数为7;钠原子核外电子排布是2、8、1,有3层,最外层电子数为1;四种元素中最外层电子数最多的原子为氯原子,其结构示意图为: 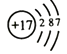 ,
,
所以答案是:  ;(2)2种元素组成的共价化合物的水溶液显酸性,该化合物只能为HCl,氯化氢属于共价化合物,分子中存在1个氢氯键,氯化氢的电子式为:
;(2)2种元素组成的共价化合物的水溶液显酸性,该化合物只能为HCl,氯化氢属于共价化合物,分子中存在1个氢氯键,氯化氢的电子式为: ![]() ,由两种元素组成的共价化合物的水溶液显碱性,该元素为N 与H,二者通过共价键结合成氨气,结构式
,由两种元素组成的共价化合物的水溶液显碱性,该元素为N 与H,二者通过共价键结合成氨气,结构式 ![]() ;氢、氮、氯和钠四种元素形成的单质分别为:H2、N2、Cl2、Na,Cl2、Na为活泼的非金属、金属单质,氢气具有较强还原性,只有氮气分子中存在氮氮三键,其化学性质稳定,氮气分子中两个氮原子共用3对电子,电子式为
;氢、氮、氯和钠四种元素形成的单质分别为:H2、N2、Cl2、Na,Cl2、Na为活泼的非金属、金属单质,氢气具有较强还原性,只有氮气分子中存在氮氮三键,其化学性质稳定,氮气分子中两个氮原子共用3对电子,电子式为 ![]() ;
;
所以答案是: ![]() ;
; ![]() ;
; ![]() ;(3)氯离子和钠离子通过离子键形成氯化钠离子化合物,化学式为:NaCl;
;(3)氯离子和钠离子通过离子键形成氯化钠离子化合物,化学式为:NaCl;
氮、氢、氯三种元素,氯离子与铵根离子通过离子键形成离子化合物氯化铵,用电子式表示其形成过程为:H+H+H+ ![]() +
+ ![]() →
→ ![]() .
.
所以答案是:NaCl;H+H+H+ ![]() +
+ ![]() →
→ ![]() .(4)所以卤原子中,F原子半径最小,所以H﹣X中,H﹣F键H﹣F键键长短,键能大,最稳定,HF稳定性最好;
.(4)所以卤原子中,F原子半径最小,所以H﹣X中,H﹣F键H﹣F键键长短,键能大,最稳定,HF稳定性最好;
所以答案是:HF;H﹣F键键长短,键能大.

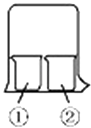
【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
①中的物质 | ②中的物质 | 预测①的现象 | |
A | 酚酞溶液 | 浓盐酸 | 无明显现象 |
B | 淀粉KI溶液 | 浓硝酸 | 无明显现象 |
C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A.A
B.B
C.C
D.D