��Ŀ����
����Ŀ��ijǿ������ҺX�����ܺ���Al3+��Ba2+��NH4+��Fe2+��Fe3+��CO32����SO42����SiO32����NO3���е�һ�ֻ������ӣ�ȡ����Һ����ʵ�飬������ת����ͼ����һ�������Ǻ���ɫ����ش��������⣺ 
��1����ҺX�г���H+һ�����ڵ������� �� ��ҺX��һ�������ڵ������� ��
��2����������A�����ӷ���ʽΪ ��
��3��ת��������Ӧ������Ϊ ��
��4��ת�� ���е����ӷ���ʽΪ ��
��5����ת�����У�D��H2O��O2��������ǡ�÷������Ϸ�Ӧ����E����Ӧ��O2��D�����ʵ���֮��Ϊ ��
���𰸡�
��1��Al3+��NH4+��Fe2+��SO42����Ba2+��CO32����SiO32����NO3��
��2��3Fe2++NO3��+4H+=3Fe3++NO+2H2O
��3�����ɫ�����ܽ⣬��Һ�ʻ�ɫ
��4��NH3+H+�TNH4+
��5��1��4
���������⣺ijǿ������ҺX������Һ�в��������������CO32����SiO32�� �� ��Һ�����ᱵ��Һ��Ӧ���ɳ���C������Һ����SO42�� �� �����ں���������ӷ�Ӧ��Ba2+ �� C��BaSO4��������������������Ӿ���ǿ�����ԣ�������Һ��Fe2+��NO3�����ܹ��棬�������ᱵ�������壬����Һ�д���Fe2+ �� ������NO3�� �� ����A��NO���ɷ�Ӧ�ڿ�֪����DΪNO2��������EΪ���
��ҺB�м����������������Һʱ����������F������Һ�к���NH4+ �� F��NH3 �� ����������������Һ�д���Fe2+ �� ����G��Fe��OH��3 �� ��ҺH��ͨ�����������̼���ɳ���������Һ�д���Al3+ �� ��ҺH�к���ƫ�����������K��Al��OH��3 �� ��ҺL��NaHCO3����1��������������ҺX�г�H+��϶����е�������Al3+��SO42����NH4+��Fe2+������ȷ���Ƿ��е�����Fe3+ �� һ�������ڵ�����ΪBa2+��CO32����SiO32����NO3�� ��
���Դ��ǣ�Al3+��SO42����NH4+��Fe2+��Ba2+��CO32����SiO32����NO3������2����������A�����ӷ���ʽΪ3Fe2++NO3��+4H+=3Fe3++NO+2H2O�����Դ��ǣ�3Fe2++NO3��+4H+=3Fe3++NO+2H2O����3��ת������Fe��OH��3�����ᷴӦ�����Ȼ�����������Ӧ������Ϊ���ɫ�����ܽ⣬��Һ�ʻ�ɫ�����Դ��ǣ����ɫ�����ܽ⣬��Һ�ʻ�ɫ����4��ת�����е����ӷ���ʽΪNH3+H+�TNH4+ �� ���Դ��ǣ�NH3+H+�TNH4+����5����ת�����У�D��H2O��O2��������ǡ�÷������Ϸ�Ӧ����E������4NO2+O2+4H2O=4HNO3 �� ��Ӧ��O2��D�����ʵ���֮��Ϊ1��4�����Դ��ǣ�1��4��

 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
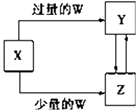
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�����Ŀ����֪X��Y��Z��W��Ϊ��ѧ��ѧ�г����ĵ��ʻ������֮���ת����ϵ��ͼ��ʾ�����ֲ�������ȥ������W��X�������ǣ� ��
ѡ�� | W | X |
A | ϡ���� | NaAlO2��Һ |
B | ϡ���� | Fe |
C | CO2 | Ca��OH��2��Һ |
D | Cl2 | Fe |
A.A
B.B
C.C
D.D