题目内容
在N2+3H2 2NH3的反应中,各物质的起始浓度分别为:c(H2)="4" mol·L-1,c(N2)="3" mol·L-1,c(NH3)="0.5" mol·L-1,经3 min后,c(NH3)="0.8" mol·L-1,该反应的反应速率是( )
2NH3的反应中,各物质的起始浓度分别为:c(H2)="4" mol·L-1,c(N2)="3" mol·L-1,c(NH3)="0.5" mol·L-1,经3 min后,c(NH3)="0.8" mol·L-1,该反应的反应速率是( )
 2NH3的反应中,各物质的起始浓度分别为:c(H2)="4" mol·L-1,c(N2)="3" mol·L-1,c(NH3)="0.5" mol·L-1,经3 min后,c(NH3)="0.8" mol·L-1,该反应的反应速率是( )
2NH3的反应中,各物质的起始浓度分别为:c(H2)="4" mol·L-1,c(N2)="3" mol·L-1,c(NH3)="0.5" mol·L-1,经3 min后,c(NH3)="0.8" mol·L-1,该反应的反应速率是( )| A.v(H2)="0.7" mol·(L·min)–1 | B.v(NH3)="0.3" mol·(L·min)-1 |
| C.v(H2)="0.2" mol·(L·min)-1 | D.v(H2)="0.15" mol·(L·min)-1 |
D
N2 + 3H2 2NH3
2NH3
起始浓度/mol·L 3 4 0.5
3 min后浓度/mol·L 0.8
变化浓度/mol·L 0.15 0.45 0.3
化学反应速率的计算要掌握基本格式,以上所列,还应掌握起始浓度和某时刻后浓度的关系,即:
[反应物]减小=[反应物]起始-[反应物]某时刻
[生成物]增加=[生成物]某时刻-[生成物]起始
所以分别求得:v(N2)="0.05" mol·L·min,v(H2)="0.15" mol·(L·min),
v(NH3)="0.1" mol·(L·min)。
 2NH3
2NH3起始浓度/mol·L 3 4 0.5
3 min后浓度/mol·L 0.8
变化浓度/mol·L 0.15 0.45 0.3
化学反应速率的计算要掌握基本格式,以上所列,还应掌握起始浓度和某时刻后浓度的关系,即:
[反应物]减小=[反应物]起始-[反应物]某时刻
[生成物]增加=[生成物]某时刻-[生成物]起始
所以分别求得:v(N2)="0.05" mol·L·min,v(H2)="0.15" mol·(L·min),
v(NH3)="0.1" mol·(L·min)。

练习册系列答案
相关题目
 nZ(g)+2W(g)。5 min末生成0.2 mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为( )
nZ(g)+2W(g)。5 min末生成0.2 mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为( ) 2SO3(正反应为放热反应),使用V2O5作催化剂。下列关于催化剂的叙述中,不正确的是( )
2SO3(正反应为放热反应),使用V2O5作催化剂。下列关于催化剂的叙述中,不正确的是( ) P,如果温度每升高10℃,反应速度增加为原来的3倍,在10℃时完成反应的10%需要54min,将温度提高到40℃,完成反应的10%需要的时间为( )
P,如果温度每升高10℃,反应速度增加为原来的3倍,在10℃时完成反应的10%需要54min,将温度提高到40℃,完成反应的10%需要的时间为( ) 4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率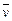 (X)(表示反应物的消耗速率或生成物的生成速率)为
(X)(表示反应物的消耗速率或生成物的生成速率)为 ,反应M+N=K在温度t2下进行,已知t1>t2,且E和F的浓度均大于M和N的浓度(其他条件均相同),则两者
,反应M+N=K在温度t2下进行,已知t1>t2,且E和F的浓度均大于M和N的浓度(其他条件均相同),则两者 的反应速率
的反应速率