题目内容
1.将新制的氯水滴入下列溶液中,不发生反应的是( )| A. | 碘化钠 | B. | 硫酸铁 | C. | 硝酸银 | D. | 氢氧化钾 |
分析 氯水中含有的微粒有:Cl2、H2O、HClO、H+、OH-、Cl-、ClO-,次氯酸有漂白性和强氧化性,氯气有强氧化性,该溶液呈酸性,所以该溶液能和碱反应、能和还原性的物质反应、和银离子生成白色沉淀.
解答 解:氯水中含有的微粒有:Cl2、H2O、HClO、H+、OH-、Cl-、ClO-,次氯酸有漂白性和强氧化性,氯气有强氧化性,该溶液呈酸性.
A.碘化钠溶液中碘离子有还原性,能被氯气氧化而生成碘单质,所以新制氯水滴入碘化钠溶液中会发生反应,故A不选.
B.硫酸铁中铁离子有氧化性,氯水有氧化性,所以两种物质混合时不发生反应,故B选.
C.氯水中含有氯离子,能和银离子反应生成白色沉淀,所以新制氯水滴入硝酸银溶液中会发生反应,故C不选.
D、氯水呈酸性能和碱发生中和反应,所以新制氯水滴入KOH溶液中会发生反应而变质,故D不选.
故选B.
点评 明确氯水成分及其性质是解本题关键,氯水中次氯酸、氯气具有强氧化性,溶液呈酸性,氯水具有漂白性,题目难度不大.

练习册系列答案
相关题目
14.粘土胶体溶液中,粘土粒子带负电,为了使粘土粒子凝聚,下列物质中用量最少但最有效的电解质是( )
| A. | Na3PO4 | B. | A12(SO4)3 | C. | BaCl2 | D. | K2SO4 |
12.下列物质的分离方法不正确的是( )
| A. | 用结晶的方法分离汽油和水 | |
| B. | 用过滤的方法除去氯化钠溶液中的泥沙 | |
| C. | 用重结晶的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾 | |
| D. | 蒸馏法分离乙酸(沸点118.)和乙酸乙酯(沸点77.1.) |
9.在一定的温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | C分解速率与B生成速率相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmol A,同时生成3nmol B | |
| D. | A、B、C的分子数之比为1:3:2 |
16.关于如图所示的原电池,下列说法正确的是( )


| A. | 电子从锌电极通过电流表流向铜电极 | |
| B. | 盐桥中的阴离子向硫酸铜溶液中迁移 | |
| C. | 取出盐桥后,电流计的指针仍发生偏转 | |
| D. | 铜电极上发生的电极反应是2H++2e-═H2↑ |
13.在给定条件下,下列加线的物质在化学反应中几乎能被完全消耗的是( )
| A. | 8.7 g二氧化锰与50 mL8 mol•L-1浓盐酸共热制取氯气 | |
| B. | 19.2 g铜与100 mL12 mol•L-1的硝酸反应 | |
| C. | 常温下,将5.4 g铝片投入20 mL18 mol•L-1的硫酸中 | |
| D. | 将足量的Cu置于50 mL18 mol•L-1H2SO4溶液中加热 |
8.有关化学用语正确的是( )
| A. | 乙烯的实验式C2H4 | |
| B. | 乙醇的分子式C2H5OH | |
| C. | 乙酸乙酯的结构简式 CH3CH2OOCCH3 | |
| D. | 羟基 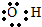 |
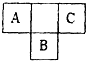 A、B、C为短周期元素,在周期表中所处位置如图所示.A、C两原子的核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处位置如图所示.A、C两原子的核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等. ,C单质的电子式是
,C单质的电子式是 .
.