题目内容
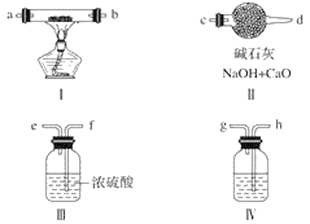
【题目】下图是一套制取并验证氯气部分化学性质的实验装置。回答下列问题:

(1)装置A中,仪器a的名称____________,该仪器中盛有的试剂为_________;
(2)当Cl2气流通过一段时间后,装置B中溶液的pH ________7(填“>”“<”或“=”),装置B中反应的化学方程式为_________________________________;
(3)当Cl2气流持续通过时,装置D中干燥的有色布条能褪色,原因是_______________;
(4)装置C中的溶液颜色由无色变为______________;装置E的作用是____________________________。
【答案】分液漏斗 浓盐酸 < Cl2+H2O = HCl + HClO 因为湿润的氯气有漂白性 蓝色 吸收多余氯气
【解析】
(1)根据仪器构造判断仪器名称,分析装置图和仪器,装置A是氯气的发生装置,据此判断需要的试剂;
(2)根据氯气和水反应生成盐酸和次氯酸分析解答;
(3)根据进入装置D的氯气没有干燥解答;
(4)根据氯气能把碘化钾氧化为单质碘以及氯气有毒分析解答。
(1)分析装置图和仪器,装置A是氯气的发生装置,利用分液漏斗将浓盐酸滴入烧瓶中加热反应,因此仪器a的名称是分液漏斗,该仪器中盛有的试剂为浓盐酸;
(2)氯气既溶解于水又和水反应生成盐酸和次氯酸,反应化学方程式为Cl2+H2O=HCl+HClO,溶液呈酸性,溶液pH小于7;
(3)当Cl2气流持续通过时,从装置C中出来的氯气带有水蒸气,氯气和水反应生成次氯酸,次氯酸具有漂白性,所以装置D中干燥的有色布条能褪色;
(4)装置C中通过氯气会发生氧化还原反应,氯气氧化碘离子为碘单质,碘单质遇到淀粉变蓝;氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,即装置E的作用是吸收多余氯气。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】(1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
A.[H+]>[HC2O4-]>[HCO3-]>[CO32-] B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-] D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(2)白磷与氧气可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH=___________。

(3)25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0×10-amol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和=___________。
(4)在t ℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钡溶液 的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c=___________。