题目内容
【题目】甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.0 kJ mol-1
CH3OH(g) △H1=-90.0 kJ mol-1
②2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
回答下列问题:
(1)若由合成气(CO、H2)制备lmolCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=________kJ mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)有人模拟该制备原理,500K时,在2L的密闭容器中充入2molCO和6mol H2,5min达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2mol·L-1,用H2表示反应①的速率是_______mol·L-1·min-1,可逆反应②的平衡常数K2=_________。
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),此时反应②的v正_______v逆(填“>”、“< ”或“=”)。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,下列说法正确的是_______。
A.在平衡移动过程中逆反应速率先增大后减小
B.容器中CH3OCH3的体积分数增大
C.容器中混合气体的平均相对分子质量减小
D.达到新平衡后体系的压强增大
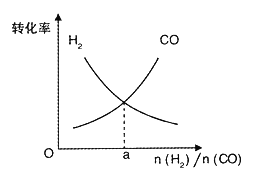
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a =_________(填数值)。
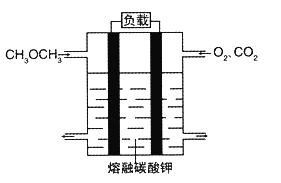
(5)绿色电源“二甲醚燃料电池”的结构图所示,电解质为熔融态的碳酸盐(如熔融 K2CO3),其中CO2会参与电极反应。工作时负极的电极反应为____________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做__________。
【答案】 -20.0 0.24 1 < A D 2 CH3OCH3-12e-+6CO32-=8CO2↑+3H2O 外加电流的阴极保护法
【解析】(1). 已知①CO(g)+2H2(g)![]() CH3OH(g) △H1= -90.0 kJmol-1 ,
CH3OH(g) △H1= -90.0 kJmol-1 ,
②2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
③H2O(l)=H2O(g) =+44.0 kJ/mol。由合成气(CO、H2)制备1molCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ可写出热化学方程式为:
④2CO(g)+4H2(g)![]() CH3OCH3(g) + H2O(l) △H4 = -244 kJ mol-1
CH3OCH3(g) + H2O(l) △H4 = -244 kJ mol-1
反应④=①![]() 2+②-③,则△H4 =2△H1+△H2-△H3,所以△H2=△H4 +△H3-2△H1=-20 kJ mol-1
2+②-③,则△H4 =2△H1+△H2-△H3,所以△H2=△H4 +△H3-2△H1=-20 kJ mol-1
(2). CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 1 3 0
转化量 0.6 1.2 0.3
平衡量 0.4 1.8 0.3
所以,用H2表示反应①的速率是V(H2)= ![]() =
=![]() = 0.24 mol·L-1·min-1。
= 0.24 mol·L-1·min-1。
②2CH3OH(g)![]() CH3OCH3(g)+ H2O(g)
CH3OCH3(g)+ H2O(g)
起始浓度(mol/L) 0.3 0 0
转化量 0.1 0.2 0.2
平衡量 0.2 0.2 0.2
所以,可逆反应②的平衡常数K2= ![]() =1
=1
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),则n(CH3OCH3)= n(H2O),Qc=![]() =4>K2,此时反应②向逆反应方向进行,所以v正<v逆。
=4>K2,此时反应②向逆反应方向进行,所以v正<v逆。
(3). 在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,由于平衡常数只受温度影响,正反应为放热反应,说明反应混合物体系的温度升高了,正、逆反应速率都增大,化学平衡向逆反应方向移动了,逆反应速率逐渐减小, 正反应速率逐渐增大;由于反应前后气体分子数不变,容器中混合气体的平均相对分子质量不变,的物质的量减少,所以 容器中CH3OCH3的体积分数减小;
虽然气体分子数不变,但是温度比原平衡升高使得达到新平衡后体系的压强增大。综上所述,AD正确。
(4). 转化率=![]()
![]() 100%,不同反应物的变化量之比等于化学计量数之比,所以当反应物的起始量之比等于化学计量数之比时,不同反应物的转化率必然是相等的。所以a=2。
100%,不同反应物的变化量之比等于化学计量数之比,所以当反应物的起始量之比等于化学计量数之比时,不同反应物的转化率必然是相等的。所以a=2。
(5). 分析二甲醚燃料电池中反应物可知,二甲醚是还原剂,氧气是氧化剂,熔融的碳酸钾为电解质,所以负极上是二甲醚失电子发生氧化反应生成二氧化碳和水,电极反应式为: CH3OCH3-12e-+6CO32-=8CO2↑+3H2O 。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做外加电流的阴极保护法。

 高中必刷题系列答案
高中必刷题系列答案【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | NaCl(泥沙) | 水 | 过滤、结晶 |
B | CO2( CO ) | O2 | 点燃 |
C | Fe(Zn ) | 稀硫酸 | 结晶 |
D | CO2(HCl ) | NaOH溶液 | 萃取 |
A.A
B.B
C.C
D.D