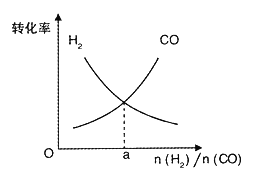
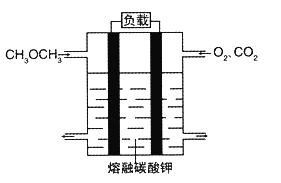
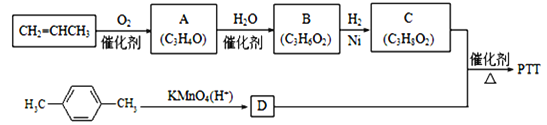
题目内容
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | NaCl(泥沙) | 水 | 过滤、结晶 |
B | CO2( CO ) | O2 | 点燃 |
C | Fe(Zn ) | 稀硫酸 | 结晶 |
D | CO2(HCl ) | NaOH溶液 | 萃取 |
A.A
B.B
C.C
D.D
【答案】A
【解析】解:A.泥沙不溶于水,NaCl溶于水,则利用水溶解后、过滤分离出泥沙,结晶滤液得到NaCl,故A正确;B.CO与氧气在二氧化碳过量时难反应,不能除杂,应利用灼热的CuO除杂,故B错误;
C.均为稀硫酸反应,不能除杂,可利用磁铁分离,故C错误;
D.二者均与NaOH溶液反应,不能除杂,应选饱和碳酸氢钠、洗气分离,故D错误;
故选A.

练习册系列答案
相关题目
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A. | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
B. | 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C. | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀。 | 酸性:H2CO3 >H2SiO3 |
D. | 室温下,用pH试纸测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 | HSO3-结合H+的能力比 SO32-的强 |
A. A B. B C. C D. D