��Ŀ����
����Ŀ���뼰�仯�����Ӧ�������汻���ӡ�
(1)����Ҫ�ĺ������������ʯ����2%��(Cr)������ʯ��Ϊ��ĸ�̡���̬Crԭ�Ӽ۵��ӵĹ����ʾʽΪ____________��
(2)���������������Ԫ���������ơ������й��������������ȷ����________(����ĸ)��
A.������p������Ԫ�� B.�縺�Զ���þ��
C.��һ�����ܶ���þ�� D.�롢þ�����������γɵĻ����ᄃ��������ͬ
(3)�롢�����嶼���ɽ���ԭ�����ò�����ά�ռ�ѻ�����(���ܶѻ�)������۵�(1551K)�������۵�(930K)�ߣ�ԭ����____________________��
(4)BeO����������ͼ��ʾ����BeO������ܶ�Ϊdg��cm-3�����߳�Ϊ________nm��

���𰸡�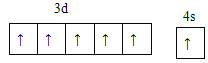 B Beԭ�Ӱ뾶��AlС
B Beԭ�Ӱ뾶��AlС ![]()
��������
(1)Cr��24��Ԫ�أ���ԭ�Ӻ�������Ų����������ȫ�����ȶ��ṹ���ݴ���д���̬ԭ�Ӽ۲�����Ų�ʽ��
(2)A.Be����s��Ԫ�أ�Al����p��Ԫ�أ�
B.Be��Al�ĵ縺�Զ���þ��
C.��������Ԫ��Mg�ĵ�һ�����ܱȵ�������Al�Ĵ�
D.�Ȼ�þ�����ӻ����BeCl2��AlCl3�ǹ��ۻ����
(3)���������۷е�������������ȣ���������ԭ�Ӱ뾶�ɷ��ȣ�
(4)���㾧���к��е�O2-��Be2+�ĸ�����Ȼ����ݾ����ܶ�![]() ����V=a3���㾧��������
����V=a3���㾧��������
(1)Cr����24��Ԫ�أ���ԭ�Ӻ�������Ų����������ȫ�����ȶ��ṹ����̬ԭ�Ӽ۲�����Ų�ʽΪ3d54s1�������Ų�ͼΪ�� ��
��
(2)���������������Ԫ���������ơ�
A.Be����s����Al����p����A����
B.Ԫ�صĽ�����Խǿ��Խ����ʧȥ���ӣ�Ԫ�صĵ縺�Ծ�ԽС������Be��Al�Ľ����Ա�Mg��������Ԫ�صĵ縺�Զ���þ��B��ȷ��
C.�������ڵ�IIAԪ��Mg�ĵ�һ�����ܱȵ������ڵ�IIIA��Al�Ĵ�C����
D.MgCl2�����ӻ������̬ʱ�������Ӿ��壬��BeCl2��AlCl3�ǹ��ۻ�����ڹ�̬ʱ���ڷ��Ӿ��壬���ʵľ������Ͳ���ͬ��D����
�ʺ���ѡ����B��
(3)Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ������۵�������۵�ߣ�
(4)��BeO�����У��þ�����O2-����=8��![]() +6��
+6��![]() =4��Be2+����=1��4=4����BeO������ܶ�Ϊdg/cm3�����ݾ����ܶ�
=4��Be2+����=1��4=4����BeO������ܶ�Ϊdg/cm3�����ݾ����ܶ�![]() ����֪��������a=
����֪��������a=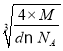 ��10-7nm=
��10-7nm=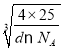 ��10-7nm=
��10-7nm=![]() nm��
nm��

 ����������������ϵ�д�
����������������ϵ�д�