题目内容
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO47H2O),流程如图:
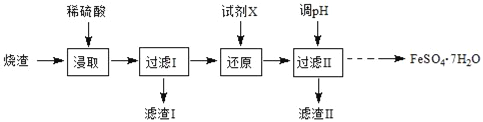
(1)滤渣Ⅰ的主要成分是_________(填化学式)。
(2)还原时,试剂X若选用SO2,则反应后的阴离子是_________(填化学式)。
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是_________、_________、过滤、洗涤、干燥。
(4)七水合硫酸亚铁(FeSO47H2O) 在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应),发生的反应为:MnO4﹣+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。
①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要_________、_________。
②该补血剂中亚铁离子的含量为_________mg/片。
【答案】 SiO2 SO42﹣ 蒸发浓缩 冷却结晶 玻璃棒 250 mL容量瓶 56
【解析】(1)二氧化硅不与稀硫酸反应,滤渣1为二氧化硅,化学式为 SiO2;
(2)试剂X若选用SO2,发生反应:SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+,则阴离子为SO42﹣;
(3)滤渣Ⅱ为氢氧化铝,即Al(OH)3,溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得到FeSO4·7H2O;
(4)①配制250mL溶液需要的玻璃仪器除有烧杯、胶头滴管、玻璃棒、250 mL容量瓶;
②根据MnO4﹣~5Fe2+之间的关系,25mL溶液中:n(Fe2+)=5 n(MnO4﹣)=5×0.0100mol/L×20.00×10﹣3L=10﹣3 mol,250 mL溶液中:n(Fe2+)=10﹣3 mol×10=10﹣2mol,1片补血剂样品中:n(Fe2+)=10﹣3mol,m(Fe2+)=10﹣3mol×56g/mol=0.056g=56 mg;

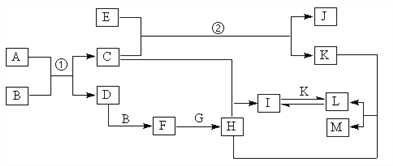
【题目】硫代硫酸钠(Na2S2O3)俗称大苏打,主要用于照相业作定影剂.Na2S2O3易溶于水,在酸性溶液中会迅速分解,具有较强的还原性.
(1)Na2S2O3溶液与足量氯水反应的离子方程式为 . (S元素被氧化为SO ![]() )
)
(2)硫代硫酸钠(Na2S2O3)露置在空气中易氧化变质,其可能的变质后生成物如下:假设一:
假设二:只有Na2SO4固体
假设三:
(3)现有一瓶Na2S2O3固体,可能混有Na2SO4固体.设计实验验证该假设,写出实验步骤、预期现象和结论.限选试剂:1molL﹣1 H2SO4、1molL﹣1HNO3、1molL﹣1HCl、1molL﹣1NaOH、0.1molL﹣1BaCl2、0.01molL﹣1KMnO4、蒸馏水.
实验步骤 | 预期现象和结论 |
步骤1:取少量固体于试管中,加蒸馏水溶解. | |
步骤2: | |
步骤3: |