题目内容
16.实验室用如图所示装置制备干燥纯净的氯气,并进行氯气的性质实验.请回答下列问题:
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的离子方程式为:MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)C中盛有饱和食盐水,其作用是除去氯气中的HCl,D中浓硫酸的作用是干燥氯气.
(3)F中是FeCl2溶液,F中发生反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;
(4)G中是AgNO溶液,现象是溶液中出现白色浑浊
(5)H中盛有Na0H溶液,其作用是吸收氯气,防止污染.
(6)若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.5mol(填“大于”、“等于”或“小于”),若用8.7g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是0.2mol.
分析 (1)二氧化锰与浓盐酸加热生成氯化锰、氯气和水;
(2)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯化氢易溶于水,浓硫酸具有吸水性;
(3)氯气具有强的氧化性,能够氧化二价铁离子;
(4)氯气与水反应生成盐酸和次氯酸,盐酸与硝酸银反应生成氯化银沉淀;
(5)氯气有毒,不能直接排放,氯气与氢氧化钠反应生成次氯酸钠和氯化钠,可以用来进行尾气处理;
(6)二氧化锰只能与浓盐酸反应,与稀盐酸不反应.
解答 解:(1)二氧化锰与浓盐酸加热生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气,
故答案为:除去挥发出的HCl气体;干燥氯气;
(3)氯气与氯化亚铁反应生成氯化铁,离子方程式:Cl2+2Fe2+=2Cl-+2Fe3+,故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
(4)氯水中含有氯离子,氯离子与硝酸银反应生成白色的氯化银沉淀,故答案为:溶液中出现白色浑浊;
(5)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气;
故答案为:吸收氯气,防止污染;
(6)浓盐酸中含有HCl:0.2L×10mol/L═2mol根据化学方程式:可知在二氧化锰过量的条件下,如果HCl完全反应,会生成氯气0.5mol,但是随着反应的进行,盐酸的浓度逐渐减小,稀盐酸与二氧化锰不再反应,所以生成的氯气小于0.5mol;
8.7g二氧化锰的物质的量为0.1mol,浓盐酸过量,反应生成的氯气依据二氧化锰计算,
在MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应中,当有4molHCl参加反应时,有2molHCl被氧化,则
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O 被氧化的HCl
1mol 2mol
0.1mol 0.2mol
被氧化的浓盐酸物质的量为0.2mol;
故答案为:小于;0.2mol.
点评 本题考查了氯气的制备和性质的检验,明确反应原理是解题关键,注意二氧化锰只能氧化浓盐酸,与稀盐酸不反应,足量二氧化锰与定量浓盐酸反应,生成的氯气小于理论数值,题目难度不大.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | 易导电 | B. | 易导热 | C. | 有延展性 | D. | 易锈蚀 |
| A. | 通入酸性KMnO4溶液 | B. | 通入澄清石灰水 | ||
| C. | 通入足量的溴水 | D. | 通入浓硫酸 |
 现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:
现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:①向溶液中加入1~2滴指示剂.
②取20.00mL标准溶液放入锥形瓶中.
③用氢氧化钠溶液滴定至终点.
④重复以上操作.
⑤配制250mL盐酸标准溶液.
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的操作顺序是⑤②①③④⑥(填序号),上述②中使用的仪器除锥形瓶外,还需要酸式滴定管,使用酚酞作指示剂.
(2)滴定并记录V(NaOH)的初、终读数.数据记录如下表:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(标准溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
V(NaOH)=$\frac{19.98+20.00+20.80+20.02}{4}$mL=20.02mL
他的计算合理吗?不合理.理由是第3组数据明显偏大,不应采用.
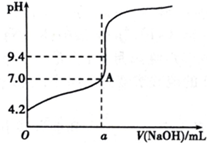
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如下图所示,则a< 20.02(填“>”“<”或“=”).



 和
和 ⑤H2O和H2O2
⑤H2O和H2O2 .
.

