题目内容
11.短周期元素A、B,原子最外层电子排布式分别为(n+1)sx、nsx+1npx+3,A与B可形成化合物C和D.D溶于水时有气体B逸出,B能使带火星的木条复燃.(1)写出物质的化学式ANaBO2CNa2ODNa2O2
(2)比较电离能:
①I1(A)<I1(B)(填“>”或“<”,下同),
②I1(B)<I1(He).
(3)通常A元素的化合价是+1,对A元素呈现这种价态进行解释:
①用原子结构的观点进行解释:钠原子失去一个电子后形成电子排布为1s22s22p6,原子轨道全充满的+1价阳离子,该离子结构体系能量低,极难再失去电子.
②用电离能的观点进行解释:Na原子的第一电离能相对较小,第二电离能比第一电离能大很多倍.通常Na原子只能失去一个电子.
③写出D跟水反应的离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑.
分析 A、B都是短周期元素,原子最外层电子排布式分别为(n+1)sx、nsx+1npx+3,故x+1=2,解得x=1,故A的外层电子排布式分别为(n+1)s1,处于第ⅠA族,B外层电子排布式分别为ns2np4,处于第ⅥA族,A与B可形成化合物D,D溶于水时有气体逸出,该气体能使带火星的木条复燃,该气体为O2,故化合物D为Na2O2,A为Na,B为O,A与B可形成化合物C和D,则C为Na2O,结合物质性质与元素周期律解答.
解答 解:A、B都是短周期元素,原子最外层电子排布式分别为(n+1)sx、nsx+1npx+3,故x+1=2,解得x=1,故A的外层电子排布式分别为(n+1)s1,处于第ⅠA族,B外层电子排布式分别为ns2np4,处于第ⅥA族,A与B可形成化合物D,D溶于水时有气体逸出,该气体能使带火星的木条复燃,该气体为O2,故化合物D为Na2O2,A为Na,B为O,A与B可形成化合物C和D,则C为Na2O,
(1)根据上面的分析可知,A为Na,B为O2,C为Na2O,D为Na2O2,故答案为:Na;O2;Na2O;Na2O2;
(2)同周期自左而右,第一电离能增大,同主族自上而下第一电离能减小,故电离能I1(A)<I1(B),He为稀有气体,是一种稳定结构,所以I1(B)<I1(He),故答案为:<;<;
(3)Na元素的化合价是+1,故答案为:+1;
①钠原子失去一个电子后形成电子排布为1s22s22p6,原子轨道全充满的+1价阳离子,该离子结构体系能量低,极难再失去电子,故通常化合价为+1;
故答案为:钠原子失去一个电子后形成电子排布为1s22s22p6,原子轨道全充满的+1价阳离子,该离子结构体系能量低,极难再失去电子;
②Na原子的第一电离能相对较小,第二电离能比第一电离能大很多倍,通常Na原子只能失去一个电子,化合价为+1价;
故答案为:Na原子的第一电离能相对较小,第二电离能比第一电离能大很多倍.通常Na原子只能失去一个电子;
③过氧化钠跟水反应生成氢氧化钠与氧气,反应离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑.
点评 本题考查结构性质与位置关系、核外电子排布规律、电离能、化合价等,难度不大,根据原子结构结合性质推断元素是解题的关键,注意掌握电离能的递变规律.

 期末集结号系列答案
期末集结号系列答案| A. | a原子电子层数比b原子的电子层数多 | |
| B. | a原子的最外层电子数比b原子的最外层电子数少 | |
| C. | 1mol a 从酸中置换出的H2比1 mol b从酸中置换出的H2多 | |
| D. | 常温时,a能从水中置换出氢气,而b不能 |
| A. | 液氨受热蒸发 | B. | 加热碘化氢气体使之分解 | ||
| C. | 加热氯化钠晶体使之熔化 | D. | HCl气体溶于水 |
| A. | NH4NO3 | B. | SiO2 | C. | C5H10 | D. | Fe |
| A. | 石油裂解的目的是获得更多的轻质液体燃料 | |
| B. | 石油裂化主要是得到乙烯、丙烯等小分子烃 | |
| C. | 石油分馏是物理变化,可分离得到汽油、柴油、煤油等多种馏分,它们都是纯净物 | |
| D. | 煤的干馏是化学变化,可从得到的煤焦油中提取苯,甲苯等重要的化工原料 |

 命名:2,2,3,4-四甲基戊烷.
命名:2,2,3,4-四甲基戊烷.

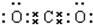
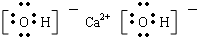


 .
.