题目内容
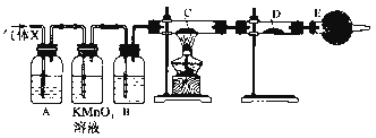
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去)。试回答:
(1)上述反应中生成二氧化硫的化学方程式为__________________。
(2)乙同学认为还可能产生氢气的理由是__________________。
(3)丙同学在安装好装置后,必须首先进行的一步操作是:_________________。
(4)A中加入的试剂可能是________,作用是__________________;
B中加入的试剂可能是________,作用是__________________;
E中加入的试剂可能是________,作用是____________________。
(5)可以证明气体X中含有氢气的实验现象是:C中:________,D中:________。如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?________(填“能”或“不能”),原因是________________________。
【答案】 Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O 当Zn与浓硫酸反应时,浓硫酸浓度逐渐变小,Zn与稀硫酸反应可产生H2 检查装置的气密性 品红溶液 检验SO2 浓硫酸 吸收水蒸气 碱石灰 防止空气中的水蒸气进入D中 黑色(CuO)粉末变成红色(Cu) 白色粉末变成蓝色 不能 因为混合气体中可能含水蒸气,会干扰H2的检验
ZnSO4+SO2↑+2H2O 当Zn与浓硫酸反应时,浓硫酸浓度逐渐变小,Zn与稀硫酸反应可产生H2 检查装置的气密性 品红溶液 检验SO2 浓硫酸 吸收水蒸气 碱石灰 防止空气中的水蒸气进入D中 黑色(CuO)粉末变成红色(Cu) 白色粉末变成蓝色 不能 因为混合气体中可能含水蒸气,会干扰H2的检验
【解析】(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水,反应的化学方程式为Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O (浓),因此,本题正确答案是: Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O (浓),因此,本题正确答案是: Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O ;
ZnSO4+SO2↑+2H2O ;
(2)反应时浓H2SO4(浓)浓度逐渐变稀,Zn与稀H2SO4反应可产生H2,和硫酸锌,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;因此,本题正确答案是: 当Zn与浓硫酸反应时,浓硫酸浓度逐渐变小,Zn与稀硫酸反应可产生H2。
(3)装置是气体验证食盐,所以需要装置气密性完好,实验开始先检验装置的气密性,因此,本题正确答案是:检查装置的气密性。
(4)分析装置图可以知道,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中 的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰,因此,本题正确答案是:品红溶液; 检验SO2;浓硫酸;吸收水蒸气;碱石灰;防止空气中的水蒸气进入D中。
(5)证明生成的气体中含有氢气的现象,C装置中黑色氧化铜变为红色铜,D装置中白色硫酸铜变为蓝色,因此,本题正确答案是:黑色的CuO变成红色的Cu,白色粉末变成蓝色。去掉装置B,高锰酸钾溶液中的水蒸气可能会使D中出现蓝色,但不能根据此现象判断气体X中有氢气。答案:不能 . 因为混合气体中可能含水蒸气,会干扰H2的检验。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
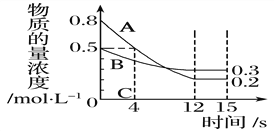
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
【题目】已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行氯气的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
① | ② | ③ | ④ | |
A | 黄绿色 | 橙色 | 蓝色 | 白色 |
B | 无色 | 橙色 | 紫色 | 白色 |
C | 黄绿色 | 橙色 | 蓝色 | 无色 |
D | 黄绿色 | 无色 | 紫色 | 白色 |
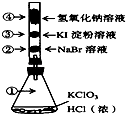
A.A
B.B
C.C
D.D