题目内容
【题目】根据元素周期表和元素周期律,下列叙述正确的有几项

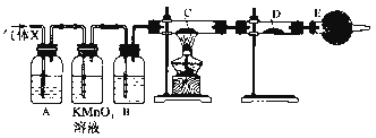
①气态氢化物的稳定性:H2O>NH3>SiH4;②氢元素与其他元素可形成共价化合物或离子化合物;③图1所示实验可证明元素的非金属性:Cl>C>Si;④用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
A. 1项 B. 2项 C. 3项 D. 4项
【答案】C
【解析】①元素的非金属性:O>N>Si,非金属性越强,其气态氢化物的稳定性越强,因此稳定性:H2O>NH3>SiH4,①正确;②氢元素与非金属元素形成共价化合物,如HCl,与金属元素形成离子化合物,如NaH,故②正确;③元素的最高价氧化物的水化物酸性越强,元素的非金属性越强。由图可知酸性:HCl>H2CO3>H2SiO3,但盐酸不是氯元素的最高价氧化物对应的水化物,因此不能比较元素的非金属性强弱,故③错误;④根据元素周期表可知:0族元素从上到下的原子序数依次为:2,10,18,36,54,86,118,则第118号元素在周期表中位于第七周期0族,故④正确;综上所述,正确的有①②④三项,C正确。

 阅读快车系列答案
阅读快车系列答案【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g·mL﹣1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1) 加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是 混合液体时最后加入浓硫酸的理由: 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点最好采用装置 (填“甲”或“乙”或“丙”)。

Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称,操作Ⅱ 。

(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是 。
(6)列式计算,苯甲酸甲酯的产率是 。