题目内容
15. 按要求完成硝酸钾晶体的制备实验:
按要求完成硝酸钾晶体的制备实验:| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① | 溶解 | 取20克KNO3和17克NaCl溶解在35ml水中,加热至沸,并不断搅拌. | 固体溶解 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩. | 有a晶体析出. |
| ③ | 热过滤 | 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为b. |
| ④ | 冷却 | 将滤液冷却至室温. | 有晶体析出. |
| ⑤ | 按有关要求进行操作 | 得到初产品硝酸钾晶体 | |
⑥ | 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤. | 得到纯度较高的硝酸钾晶体 | |
| ⑦ | 检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象. |
(2)写出步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体,步骤⑥的操作名称重结晶,步骤⑦中产生白色沉淀的离子方程式Ag++Cl-═AgCl↓
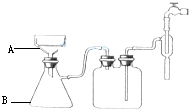
(3)步骤⑥的抽滤装置如图所示,仪器A的名称布氏漏斗,该装置中的错误之处是布氏漏斗的颈口斜面未朝向抽滤瓶的支管口; 抽滤完毕或中途需停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头.
分析 硝酸钾、氯化钠的溶解度受温度影响不同,氯化钠的溶解度受温度影响不大,NaCl的溶解度小,则溶解、蒸发浓缩后,NaCl先析出,过滤后滤液主要含KNO3,对滤液冷却结晶,溶解度受温度影响大的硝酸钾析出,将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤,得到纯度较高的硝酸钾晶体.由检验可知,⑤中含NaCl,而⑥中不含NaCl,以此来解答.
解答 解:硝酸钾、氯化钠的溶解度受温度影响不同,氯化钠的溶解度受温度影响不大,NaCl的溶解度小,则溶解、蒸发浓缩后,NaCl先析出,过滤后滤液主要含KNO3,对滤液冷却结晶,溶解度受温度影响大的硝酸钾析出,将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤,得到纯度较高的硝酸钾晶体.
(1)由上述分析可知,a为NaCl,b为KNO3,故答案为:NaCl;KNO3;
(2)步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体;步骤⑥的操作名称为重结晶;步骤⑦中产生白色沉淀的离子方程式为Ag++Cl-═AgCl↓,
故答案为:防止因温度降低而析出硝酸钾晶体;重结晶;Ag++Cl-═AgCl↓;
(3)由抽滤装置图可知仪器A的名称为布氏漏斗;该装置中的错误之处是布氏漏斗的颈口斜面未朝向抽滤瓶的支管口;抽滤完毕或中途需停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管;然后关闭抽气装置中的水龙头,故答案为:布氏漏斗;布氏漏斗的颈口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管;关闭抽气装置中的水龙头.
点评 本题考查混合物分离提纯的实验,为高频考点,把握硝酸钾、氯化钠的溶解度差异及混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,题目难度中等.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案| A. | 蒸馏、分馏、干馏都属于物理变化 | |
| B. | 石油裂解可以得到氯乙烯 | |
| C. | 油脂水解可得到氨基酸和甘油 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
| A. | 热稳定性:HCl>H2S>PH3 | B. | 原子半径:Na<Mg<Cl | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 碱性强弱:LiOH>NaOH>KOH |
| A. | HCl和HNO3放出H2一样多 | B. | 醋酸中放出H2最多 | ||
| C. | HCl中放出H2最多 | D. | HNO3比醋酸放出H2多 |
| A. | 两个键的之间夹角为120° | B. | B-F键的键能相同 | ||
| C. | 3个B-F键的键能相同 | D. | 3个B-F键的键长相等 |
| A. | 苯丙烯的同分异构体(包括顺反异构)共有5种 | |
| B. | 甲苯能被酸性高锰酸钾氧化为苯甲酸,而甲烷不能使酸性高锰酸钾褪色,说明有机物分子中的基团间存在相互影响 | |
| C. | 芥子醇(如图所示) 能发生氧化、取代、水解、加聚反应 能发生氧化、取代、水解、加聚反应 | |
| D. | 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成,该物质一定属于醛类 |
 现有A、B、C三种烃,其球棍模型如图:
现有A、B、C三种烃,其球棍模型如图: .
.