题目内容
【题目】如图为一个五圆环,每个环中的物质依次为FeCl3、NaCl、Na2O2、CO2、I2,图中相连的两种物质可归属为同一类,用①、②、③、④表示相交部分,请回答下列问题:
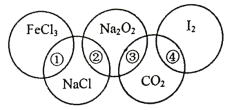
(1)关于上述相交部分的说法不正确的是___(填序号)。
A.①表示盐类 B.②表示钠的化合物
C.③表示氧化物 D.④表示非电解质
(2)关于上述相交部分的说法正确的是___(填序号)。
A.海水晒盐属于物理变化 B.Na2O2属于碱性氧化物
C.I2易溶于CCl4 D.钠着火可用CO2灭火
(3)若NaCl固体中含有少量I2杂质,可采用的除杂方法是___(填序号)
A.过滤 B.加热 C.渗析
(4)上述五种物质中,有两种物质可以发生氧化还原反应,其化学方程式为___;
(5)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol·L-1图中某物质M的溶液,继续煮沸得到红褐色透明液体。
①物质M的化学式为____。
②检验该红褐色透明液体是胶体的方法为___。
【答案】D AC B 2CO2+2Na2O2=2Na2CO3+O2 FeCl3 丁达尔效应
【解析】
(1)根据物质分类判断;
(2)A.海水晒盐是蒸发,没有生成新物质;
B.Na2O2与酸反应生成盐和氧气;
C.I2是非极性分子,易溶于非极性溶剂CCl4;
D. 钠着火生成过氧化钠,过氧化钠与二氧化碳反应生成氧气,从而促进钠继续燃烧;
(3)单质I2易升华。
(4)上述五种物质中,CO2与Na2O2可以发生氧化还原反应生成碳酸钠和氧气;
(5)向沸水中滴入FeCl3溶液,继续煮沸得到红褐色氢氧化铁胶体。
(1)A. FeCl3、NaCl都是盐,所以①表示盐类,故A正确;
B. NaCl、Na2O2都是含有钠的化合物,所以②表示钠的化合物,故B正确;
C. Na2O2、CO2都是氧化物,所以③表示氧化物,故C正确;
D. I2既不是电解质又不是非电解质,所以④不一定表示非电解质,故D错误;选D。
(2)A.海水晒盐是蒸发,没有生成新物质,属于物理变化,故A正确;
B.Na2O2与酸反应生成盐和氧气,所以Na2O2不是碱性氧化物,故B错误;
C.I2是非极性分子,易溶于非极性溶剂CCl4,故C正确;
D. 钠着火生成过氧化钠,过氧化钠与二氧化碳反应生成氧气,从而促进钠继续燃烧,所以不能用二氧化碳灭火,故D错误;选AC。
(3)单质I2易升华,若NaCl固体中含有少量I2杂质,可采用的除杂方法是加热升华,选B;
(4)CO2与Na2O2可以发生氧化还原反应生成碳酸钠和氧气,反应的方程式是2CO2+2Na2O2=2Na2CO3+O2;
(5)①向沸水中滴入FeCl3溶液,继续煮沸得到红褐色氢氧化铁胶体,则物质M的化学式为FeCl3。
②胶体能发生丁达尔效应,检验该红褐色透明液体是胶体的方法为丁达尔效应。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。