题目内容
【题目】工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:
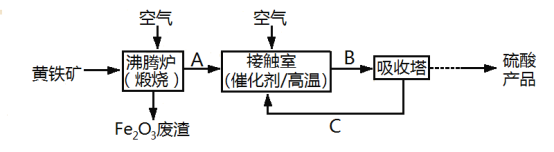
回答下列问题:
(1)在接触室中发生的反应是2SO2+O2![]() 2SO3,该反应属于__________(填字母)
2SO3,该反应属于__________(填字母)
a.氧化还原反应 b.离子反应
c.化合反应 d.可逆反应
(2)Fe2O3废渣的用途有________________________(答出一条即可)。
(3)写出沸腾炉中发生反应的化学方程式:________
(4)取硫酸产品加入蔗糖中,有“黑面包”现象发生,该过程体现出浓硫酸的性质是_____。
【答案】acd 生产涂料、生产红色油漆、冶炼铁 4FeS2+11O2![]() 2Fe2O3+8SO2 脱水性和氧化性
2Fe2O3+8SO2 脱水性和氧化性
【解析】
(1)在接触室中发生的反应是2SO2+O2![]() 2SO3,该反应中S化合价升高,O化合价降低,属于氧化还原反应,同时也是可逆反应和化合反应;
2SO3,该反应中S化合价升高,O化合价降低,属于氧化还原反应,同时也是可逆反应和化合反应;
(2)Fe2O3废渣是红色固体,用途有生产涂料、生产红色油漆、冶炼铁等;
(3)黄铁矿(FeS2)和氧气反应生成Fe2O3和SO2;
(4)取硫酸产品加入蔗糖中,浓硫酸具有脱水性,会把有机物中的氢和氧按2:1的比例脱出来,剩下碳,所以会变黑;浓硫酸具有强氧化性会和C反应生成二氧化碳和二氧化硫气体散发出来,所以就会形成蓬松的像面包一样。
(1)在接触室中发生的反应是2SO2+O2![]() 2SO3,该反应中S化合价升高,O化合价降低,属于氧化还原反应,同时也是可逆反应和化合反应,故选acd;
2SO3,该反应中S化合价升高,O化合价降低,属于氧化还原反应,同时也是可逆反应和化合反应,故选acd;
(2)Fe2O3废渣是红色固体,用途有生产涂料、生产红色油漆、冶炼铁等;
(3)黄铁矿(FeS2)和氧气反应生成Fe2O3和SO2,该反应是氧化还原反应,根据得失电子守恒和原子守恒可得方程式为:4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
(4)取硫酸产品加入蔗糖中,浓硫酸具有脱水性,会把有机物中的氢和氧按2:1的比例脱出来,剩下碳,所以会变黑;浓硫酸具有强氧化性会和C反应生成二氧化碳和二氧化硫气体散发出来,所以就会形成蓬松的像面包一样,故该过程体现出浓硫酸的性质是脱水性和氧化性。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数