题目内容
工业上通过电解饱和的食盐水来制取氯气。现取100mL含NaCl为11.7g的饱和食盐水进行电解,
(1)写出电解饱和食盐水制取氯气的化学方程式
(2)在标准状况下制得Cl2多少升?
(3)所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
(1) 2NaCl + 2H2O =" 2NaOH" + Cl2↑+ H2↑ 2分
(2)2.24L (3分) (3)2 mol/L (3分)
解析试题分析:n(NaCl)=11.7÷58.5=0.2mol
2NaCl + 2H2O =" 2NaOH" + Cl2↑+ H2↑
0.2mol 0.2mol 0.01mol
标准状况下制得Cl2体积为2.24L;所得NaOH的物质的量浓度c=" 0.2mol÷0.1L=2" mol/L
考点:考查根据化学方程式计算有关问题。

练习册系列答案
相关题目
Na2O2曾经是潜水艇或航天器中最理想的供氧剂。下表是人体呼出气体的成分(均为体积百分含最)。
| | 空气 成分 | 人体呼出 气体成分 |
| N2 | 78% | 74% |
| O2 | 21% | 16% |
| H2O | 0. 5% | 6% |
| CO2 | 0. 03% | 4% |
(1)已知一个人一天大约要产生16 mol CO2。若全部被Na2O2吸收,需要Na2O2________ g。
(2)若要使被吸收的CO2与产生的O2体积相等,就需
要在Na2O2中添加KO2.计算要达到该目的.Na2O2与KO2的物质的量比例是 。
已知:4KO2+2CO2=2K2CO3+3O2
(3)计算100 L空气经过人体呼吸后,呼出气体中O2的体积(标准状况下,保留2位小数)____ L。
(4)为保持航天器中空气成分恒定,并充分利用资源,需对人体呼出的气体进行处 理,无用物质排出航天器。100 L空气经过人体呼吸后,欲使呼出的气体经过处理后恢复原空气成分且体积仍为100 L(可供使用的化学试剂只有Na2O2).通过计算回答:若先利用CO2,还需要利用水蒸气,求需要水蒸气体积 L。
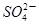 的物质的量浓度_____________mol/L;
的物质的量浓度_____________mol/L; B.
B. C.
C. D.
D.
