题目内容
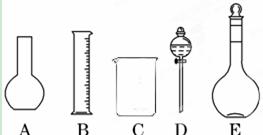
下面是几种实验中常用的仪器:
A. B.
B. C.
C. D.
D.
(1)写出序号所代表的仪器的名称:B___________;C___________;D___________
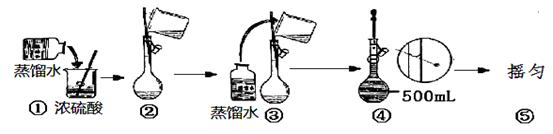
实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)下列主要操作步骤的正确顺序是_______________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②“定容”
③待冷却至室温后,将溶液转移到500 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2—3次,洗涤液转移到容量瓶中。
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配浓度偏高的是__________。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
(5)写出步骤②“定容”的具体操作:
(6)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。某学生课
外活动小组欲从海藻中提取碘,设计如下的流程:
(已知过程②中反应的离子方程式为:2I- + Cl2 = 2Cl- + I2)
Ⅰ.指出提取碘的过程中有关的实验操作的名称:① , ③ 。
Ⅱ.提取碘的过程中,可选择的有机溶剂是 (填序号) 。
A、酒精 B、醋酸 C 、四氯化碳
(1)B 1000ml容量瓶C 冷凝器D 分液漏斗(2)4.0 (3)①③⑤②④ (4)④⑤
(5)加水至液面离刻度线1—2cm时,改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切。(6)Ⅰ过滤 萃取分液(或萃取)。Ⅱ.C。
解析试题分析:配制一定体积一定浓度的物质的量浓度的溶液步骤是:计算、称量、溶解、转移溶液、洗涤、定容、摇匀。所以主要操作步骤的正确顺序是①③⑤②④。由于C=n∕V=m∕MV.若分母偏小则浓度偏高。没有洗涤烧杯和玻璃棒使溶质质量偏少,浓度偏低;转移溶液时不慎有少量洒到容量瓶外面致使溶质质量偏少,浓度偏低;容量瓶不干燥,含有少量蒸馏水不会产生任何影响;定容时俯视刻度线使溶液的体积偏小,浓度偏高。NaOH溶解时放热,未冷却到室温就将溶液转移到容量瓶并定容,当恢复至室温时溶液的体积低于刻度线,即V偏小浓度偏高。萃取剂应该是与原来的溶剂互不相容且溶质在萃取剂中的要比在原来溶剂中要大,只有四氯化碳符合条件
考点:考查一些常见的仪器的识别、物质的量浓度的溶液配制步骤、注意的事项以及混合物的分离等知识。

用密度为1.84g/cm3,质量分数为98%的浓硫酸配制100mL 1.00mol/L 的稀硫酸。
(1)在容量瓶的使用方法中,下列操作不正确的是____________
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处, 用胶头滴管加蒸馏水至刻度线。 |
(2)经计算,上述浓硫酸的浓度为_______ mol/L。配制100mL1.00mol/L的稀硫酸,应用量筒量取浓硫酸的体积为_______mL(保留一位小数),量取时应选用_______ (填序号①10mL、②50mL 、③100mL)规格的量筒。
(3)请将下列步骤补充完整:
a.量取所需浓硫酸在烧杯中加适量蒸馏水溶解,待溶液冷却到室温后将其沿玻璃棒移入 mL的容量瓶中,并将洗涤液移入容量瓶中。
b.向容量瓶内加水,直到液面接近刻度线 cm时,改用 小心地加水至溶液凹液面与刻度线相切。
c.将容量瓶盖好瓶盖,摇匀。
(4)配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
转移时未洗涤烧杯,则结果 ;
所用容量瓶未干燥,则结果 ;
定容时俯视,则结果 。
关于一些重要的化学概念有下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④煤的干馏、煤的汽化和液化都属于化学变化;⑤置换反应都属于离子反应。其中正确的是( )
| A.①②⑤ | B.①②④ | C.②③④ | D.③④⑤ |
辨析以下的说法:①l6O与 l8O的转化可以通过化学反应实现;②灼烧钠的化合物时火焰呈黄色,那是发生了化学反应;③碱性氧化物一定是金属氧化物;④只由一种元素组成的物质一定是纯净物;⑤石墨与金刚石的转化是化学变化;⑥5424Cr为铬的一种核素,其核外电子数为30. 上述说法中正确的是
| A.①④⑤ | B.①③④ | C.③⑤ | D.②③⑥ |
下列实验能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 室温下,测定等浓度的CH3COOH溶液和盐酸的pH | 比较两种酸的酸性强弱 |
| B | CH3CH2Br中加入NaOH溶液加热充分反应,取上层水溶液加入AgNO3溶液 | 检验CH3CH2Br中的溴原子 |
| C | 向25ml沸水中滴加4—5滴饱和FeCl3溶液,加热至有红褐色沉淀产生 | 制备Fe(OH)3胶体 |
| D | 在某溶液中先加入HNO3溶液,再加入Ba(NO3)2溶液 | 检验溶液中是否存在SO42- |
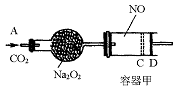
 ,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)