题目内容
【题目】如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
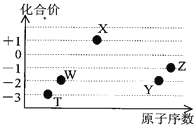
A.X的氢化物具有很强的还原性
B.YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同
C.Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4 > H2YO4
D.元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键
【答案】B
【解析】
短周期元素中,W、Y的化合价均有-2价,处于ⅥA族,则Y的原子序数较大,故W为O元素、Y为S元素;Z有-1价,原子序数大于硫,故Z为Cl,X有+1价,原子序数大于氧,则X为Na,T有-3价,处于ⅤA族,原子序数小于氧,则T为N元素。
A. X为Na,其氢化物为NaH,具有很强的还原性,故A正确;
B. SO2、ClO2、Na2O2都能使品红溶液褪色,二氧化硫与有色物质化合为无色物质,而ClO2、Na2O2具有强氧化性,将有色物质氧化为无色物质,褪色原理不相同,故B错误;
C. Y、Z元素的最高价氧化物对应的水化物分别为H2SO4、HClO4,都呈酸性,由于非金属性Cl > S,故酸性:HClO4 > H2SO4,故C正确;
D. 元素W、T的氢化物分别为H2O、NH3,这两种氢化物分子间存在氢键,它们的沸点比同主族中相邻的氢化物高,故D正确。
综上所述,答案为B。

练习册系列答案
相关题目