题目内容
18.海水淡化后得到母液,如图是某化工厂对海水资源综合利用的示意图:
请回答:
(1)下列金属中,其冶炼方法与镁相同的是ac(填序号).
a.Na b. Fe c.Al d.Hg
(2)已知溴的沸点是59℃.操作1和操作2的名称分别是过滤、萃取分液.
(3)反应①的离子方程式是SO2+Br2+2H2O=4H+=SO42-+2Br-;反应②的离子方程式是Mg(OH)2+2H+=Mg2++2H2O.
(4)为除去粗盐中含有的可溶性杂质硫酸盐、氯化钙和氯化镁可选择的除去杂质的试剂及其加入的顺序为NaOH、BaCl2、Na2CO3.
分析 海水淡化得到母液分离得到粗盐、母液,母液中通入氯气得到溴单质,在空气吹出溴单质用二氧化硫水溶液吸收得到含HBr等物质的溶液,通入氯气萃取分液得到溴单质;母液中加入氢氧化钙生成氢氧化镁沉淀,加入稀盐酸溶解得到氯化镁溶液,浓缩蒸发,得到氯化镁晶体,失水后得到固体氯化镁,电解熔融氯化镁得到金属镁;
(1)依据金属冶炼的方法分析判断,镁的冶炼是电解熔融氯化镁得到;
(2)分析流程可知操作1为过滤,操作2为萃取分液;
(3)反应①是二氧化硫和溴单质反应生成硫酸和溴化氢,反应②是氢氧化镁溶解于盐酸生成氯化镁和水;
(4)碳酸钠可除去钙离子,NaOH可除去镁离子,氯化钡可除去钡离子,但碳酸钠一定在氯化钡之后.
解答 解:(1)镁的冶炼是电解熔融氯化镁得到,金属Na是电解熔融NaCl,和镁的制备方法相同,Al是电解熔融氧化铝,与镁的冶炼方法相同,Fe是热还原法用还原剂还原铁的氧化物得到,Hg是分解氧化物得到,
故答案为:ac;
(2)已知溴的沸点是59℃.依据流程分析可知操作1和操作2的名称分别是过滤,萃取分液,
故答案为:过滤;萃取分液;
(3)反应①是二氧化硫和溴单质反应生成硫酸和溴化氢,离子方程式为:SO2+Br2+2H2O=4H+=SO42-+2Br-;反应②是氢氧化镁溶解于盐酸生成氯化镁和水,分液的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:SO2+Br2+2H2O=4H+=SO42-+2Br-;Mg(OH)2+2H+=Mg2++2H2O;
(4)碳酸钠可除去钙离子,NaOH可除去镁离子,氯化钡可除去钡离子,但碳酸钠一定在氯化钡之后,则除去粗盐中含有的可溶性杂质CaCl2、MgCl2及Na2SO4,则所加试剂及其顺序是NaOH、BaCl2、Na2CO3,
故答案为:NaOH、BaCl2、Na2CO3.
点评 本题考查混合物分离、提纯方法的选择,为高频考点,把握离子的性质及除杂的试剂选择和顺序为解答的关键,侧重粗盐提纯的考查,题目难度不大.

| A. | 苯与溴反应制溴苯 | |
| B. | 苯与浓硝酸在浓硫酸作用下制硝基苯 | |
| C. | 乙醇与乙酸的酯化反应 | |
| D. | 一定条件下苯与氢气反应制环己烷 |
| A. | 燃烧 | B. | NaOH溶液 | ||
| C. | 溴的四氯化碳溶液 | D. | 酸性高锰酸钾溶液 |
①苯不能使KMnO4溶液褪色;
②苯能在一定条件下跟H2加成生成环己烷;
③
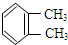 与
与 是同一物质;
是同一物质;④苯不能因化学变化而使溴水褪色.
| A. | ①②③④ | B. | ①③④ | C. | ②④ | D. | ③④ |
| A. | 脂肪 | B. | 蛋白质 | C. | 葡萄糖 | D. | 纤维素 |
| A. | 植物油不能发生水解反应 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 淀粉水解的最终产物是葡萄糖 | |
| D. | 蛋白质溶液中加重金属盐发生物理变化 |

 白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如图所示.该结构中氯原子有两种不同位置.
白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如图所示.该结构中氯原子有两种不同位置. .
.