��Ŀ����
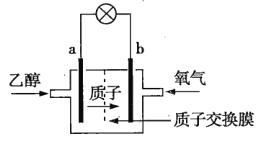
����Ŀ��1887�꣬Ӣ���˺���ɭ����������ĸɵ�أ����ɵ���Ѿ���չ��Ϊһ���Ӵ�ļ��壬�����100���֡�Ӧ�ù㷺����Zn��MnO2�ɵ�أ���������Һ��ZnCl2��NH4Cl�����Һ����ع���һ��ʱ�����ڴ���7�����ʣ�NH3��Mn2O3��ZnCl2��MnO2��NH4Cl��Zn��H2O����ش���������
��1���õ�صĸ���������__����ع���ʱ����������__��������������������������ͬ�����ŵ�ʱNH4+��___�ƶ���
��2����������ԭ��Ӧ�Ļ�ѧ����ʽΪ__��������ԭ��Ӧ��������__����������Ԫ����__������17.4g���������뷴Ӧ�������ת����ĿΪ__NA��NA��ʾ�����ӵ�������ֵ����
��3����ͨп�̵�ص�ȱ���ǵ���С���ŵ��������Ϊ����ŵ�������ɰѸ���пƬ��Ϊп�ۣ���������___��
��4����ZnCl2��NH4Cl�����Һ�к�������Cu2+�������ij�缫�ĸ�ʴ������Ҫԭ����__������ȥCu2+�����ѡ�������Լ��е�__������ţ���
a.NaOH b.Zn c.Fe d.NH3��H2O
���𰸡�Zn����п�� ���� ���� Zn+2MnO2+2NH4Cl=ZnCl2+Mn2O3+H2O+2NH3�� MnO2 Zn 0.2 ʹ��Ӧ���������߷ŵ�Ч�� п���û�������ͭ����ͭпԭ��ض��ӿ�п�ĸ�ʴ b
��������
��ظ����ǻ��ý�������������Ӧ�������ɵ�ظ���������������Һ�����������ƶ����������������ƶ������ݵ缫��Ӧ������صļ��㣬�ݴ˽��
��1����ظ����ǻ��ý�������������Ӧ�����Ը���������п�������ɸ��������������ŵ�ʱ�������������ƶ���
��Ϊ��п��������������
��2��пʧȥ���ӣ�����������Ӧ����п���ӣ����������̵õ��ӣ�������ԭ��Ӧ�������������̣����ݵ�ʧ�����غ���ƽ�ã�2MnO2+2NH4Cl+Zn=NH3��+Mn2O3+ZnCl2+H2O�����������е�����+4�۱��+3�ۣ�������ԭ��Ӧ����������17.4g MnO2�����ʵ���= ![]() =0.2mol��������+4�۱��+3�ۣ�1mol MnO2ת��1mol���ӣ���0.2mol MnO2ת��0.2mol���ӡ�
=0.2mol��������+4�۱��+3�ۣ�1mol MnO2ת��1mol���ӣ���0.2mol MnO2ת��0.2mol���ӡ�
����2MnO2+2NH4Cl+Zn=NH3��+Mn2O3+ZnCl2+H2O��MnO2��Zn��0.2��
��3��пƬ��Ϊп�ۣ�������������Ӧ��������
��Ϊ��ʹ��Ӧ���������߷ŵ�Ч�ʡ�
��4���绯ѧ��ʴ�Ȼ�ѧ��ʴ���죬п���û�������ͭ����ͭпԭ��ض��ӿ�п�ĸ�ʴ������ʱ���ܳ�ȥ�����ֲ��������µ��������ӣ�����a���d�������Һ�е�Zn2+��Ӧ��c�������������Fe2+������ѡb�
��Ϊ��п���û�������ͭ����ͭпԭ��ض��ӿ�п�ĸ�ʴ��b��